Основные отличия
Изучая свойства насыщенного и ненасыщенного пара, можно найти несколько отличий. Среди них выделяются:
- Для насыщенного газообразного вещества важными параметрами являются плотность и давление. Для ненасыщенного эти факторы не имеют большого значения.
- Для ненасыщенного пара при одинаковой температуре изменение объема влечет за собой увеличение или уменьшение давления. Для насыщенного вещества эти 2 фактора не оказывают совместного влияния. Они работают независимо.
- Для ненасыщенного пара нет зависимости плотности от температуры.
- При увеличении температуры у ненасыщенного газообразного вещества в линейной зависимости поднимается давление. У насыщенного — по экспоненциальной кривой графика.
-
Кто счастлив в поэме кому на руси жить хорошо кратко
-
Методы демографического анализа кратко
-
План мероприятий по профилактике гриппа и орви в школе 2020 2021
-
Чему и как учили в школах египта кратко
- Приказ о переводе на обучение по индивидуальному учебному плану в школе образец
Запаривание банных веников
Для бани заготавливают веники из различных видов растений. Каждое из них обладает своими полезными свойствами и оказывает на организм человека определённое воздействие.
Дубовые веники содержат в своём составе большое количество дубильных веществ. Попадая в воздух они активно воздействуют на кожу человека, избавляя ей от гнойничковых ран и избавляя ноги от излишней потливости.


Специально для ароматизации воздуха в парной запаривают хвойные веники. Это помогает избавиться от различных воспалительных процессов, облегчить затруднённое дыхание и избавиться от ран и язв на теле.
Омолаживают кожу пары настоев берёзового и рябинового веника. Особенно полезен берёзовый пар для курильщиков. Он хорошо очищает лёгкие человека.
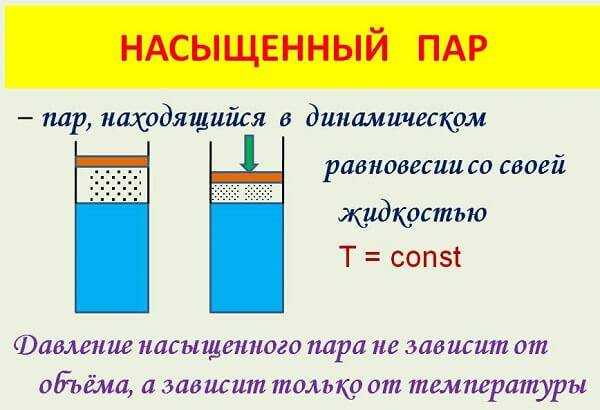
Свойства и применение насыщенного пара
К свойствам насыщенного пара относят:
- Если температура постоянна, его плотность не зависит от занимаемого объема.
- Давление, которое оказывает насыщенный пар на стенки сосуда, не зависит от объема.
- Плотность пара увеличивается, если наблюдается возрастание температуры, а также уменьшается, если температура снижается.
Применение пара основано на его свойствах. В быту его применяют в качестве источника обогрева. Так, подводя пар к теплообменнику (раствору или обычной воде), запускают процесс конденсации. При этом отдается тепло. На таком принципе работает много теплообменных аппаратов. Кроме этого, пар может применяться и в качестве обогрева через стенку либо при непосредственном контакте с телом (продуктом).
Использование пара бывает и в качестве источника энергии, например, он является движущей силой в конструкции паровых турбин. Он помогает двигать лопасти турбин, посредством которых запускаются роторы генератора. Данный процесс необходим для выработки электричества.
Еще одним применением пара является механическое разделение жидкости. Явление называется атомизацией. В качестве примера можно привести организацию эффективного сгорания нефти, для чего обязательно ее разделение. Метод характерен для генераторов, работающих на мазуте.
С помощью пара можно очищать различные поверхности, увлажнять продукты, проводить дезинфекцию и стерилизацию и т.п.
Что такое насыщенный пар
Водяной пар, пребывающий в термодинамическом равновесии с котловой водой, является насыщенным. Это формулировка дает понимание того, что давление насыщенного пара при температуре может иметь только одно значение
В котлоагрегатах парообразование протекает при постоянном давлении и подводе тепла к котловой воде от уходящих газов. Этот процесс базируется на следующих последовательных стадиях: подпитка котла водой, подогрев ее до температуры точки насыщения, и образование сухого насыщенного пара, когда вся жидкость испаряется из него.
В паровых котлах питательная вода, пройдя через экономайзер, попадает в барабан. Из него более холодные потоки под воздействием силы тяжести опускаются по необогреваемым трубам, а поднимаются по подъёмным топочным экранам обогреваемые более горячими дымовыми газами.
Плотность пароводяной смеси в экранных пакетах уменьшается и становится ниже плотности воды в опускных трубах, что создает напор для движения пароводяной смеси по экранам в барабан, где смесь сепарируется на воду и пар.
В закрытой поверхности нагрева при не меняющейся температуре в точке насыщения устанавливается термодинамическое равновесие между котловой водой и водяным паром. Число молекул пара, выделяющихся из поверхности воды за определенное время, будет равняться числу молекул сконденсированного пара, которые перейдут обратно в воду в барабане котла.
Давление насыщенного пара
Давление насыщения в котле зависит от температуры котловой воды в равновесном термодинамическом состоянии. При росте давления, пар сжимается и баланс нарушается. Плотность пара первоначально несколько возрастает, и из паровой среды в котловую воду будет переходить больше молекул конденсата, чем наоборот.
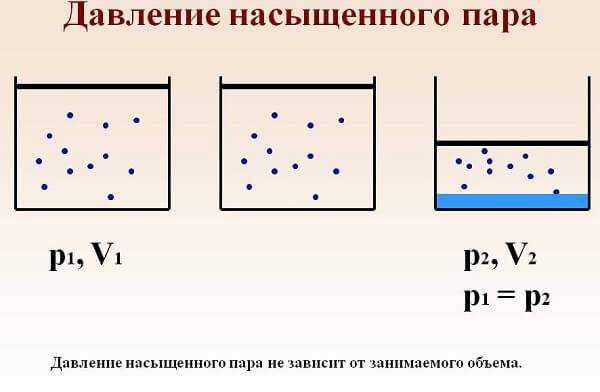
Поскольку количество молекул, переходящих из воды в единицу времени связано исключительно с температурой, то сжатие паровой среды не будет влиять на изменение этого числа.
Процесс будет протекать пока не возникнет термодинамическое равновесие, а следовательно, и концентрация возвращающихся молекул не достигнет первоначального уровня. Таким образом, Тнп напрямую зависит от давления насыщения в котле.
Таблица насыщенного пара
Характеристики сухого НП, приводятся в Таблице водяного пара. В ней указывают Т (С), при точке кипения котловой воды и давление (кПа и мм. рт.ст.) при которой этот процесс протекает.
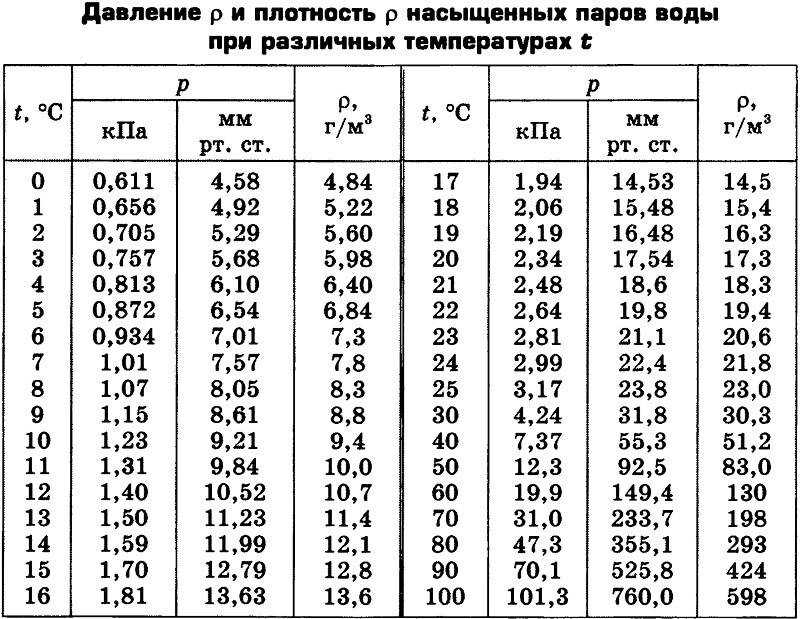
Дополнительно в таблице могут указываться и другие параметры пара:
- eдельный объем, м3/кг;
- плотность, кг/м3;
- удельная энтальпия, кДж/кг
- удельная теплота парообразования, кДж/кг.
Плотность насыщенного пара
Плотность НП определяют по формуле.
D st = 216,49 * P / (Z st * (t + 273))
Где:
- D st – плотность насыщенного пара в кг / м3;
- P- абсолютное давление пара в барах;
- t – температура в градусах Цельсия;
- Z st – коэффициент сжимаемости насыщенного пара при Р и t.
В этом уравнении символ «Z st» обозначает коэффициент сжимаемости насыщенного пара при абсолютной величине давления насыщенного водяного пара P, бар. Это удобное уравнение действительно для диапазона давления пара от 0,012 до 165 бар, с соответствующим диапазоном температур насыщения от 10 до 360 С.
Влажность насыщенного пара
Когда котлоагрегат нагревает воду, пузырьки, прорывающиеся через слой воды, захватываются паром. Влажный пар определяется как пар, в котором вода присутствует в виде микрокапель паров воды. В этом случае соотношение может составлять от 0 до 1. Если пар имеет 20 % воды по объему — он считается сухим на 80% или имеет долю сухости 0,8.
Таблицы НП содержит значения, такие как температура, энтальпия и удельный объем для сухого НП, но не для влажного. Для того чтобы их определить потребуется воспользоваться формулами, учитывая соотношение двух сред:
Удельный объем (v) мокрого пара
v = X * v g + (1 – X) * v f
Где:
- X = сухость (% / 100);
- v f = удельный объем жидкости;
- v g = удельный объем НП.
Удельная энтальпия пара сухостью Х:
h = h f + X * h fg
Где:
- X = сухость (%);
- h f = удельная энтальпия жидкости;
- h fg = удельная энтальпия НП.
Чем влажнее пар, тем ниже значения удельного объема, теплосодержание, энтальпия и энтропия. Таким образом сухость пара оказывает существенное влияние на все эти значения.
Задачей теплоэнергетиков является организация процессов парообразования в котле с сухостью 100%. Для этого в барабанах котлов устанавливают специальные сепарационные устройства, отделяющие пар от воды.
Как приготовить
 В настоящее время специализированные магазины и даже супермаркеты предлагают широкую линейку различных видов трав и комбинаций трав для запарки по средней цене за упаковку в 50 г 100 – 150 рублей.
В настоящее время специализированные магазины и даже супермаркеты предлагают широкую линейку различных видов трав и комбинаций трав для запарки по средней цене за упаковку в 50 г 100 – 150 рублей.
Но приготовить травяную смесь для запаривания в бане можно самостоятельно. Это более длительный, но очень увлекательный процесс.
Для этого необходимо:
- Утром в сухую погоду собрать лекарственные растения в соответствии со сроками их вызревания. Собирайте травы вдали от автодорог, фабрик и заводов. Не срывайте их у засеянных полей: почва в таких местах перенасыщена нитратами и пестицидами. Не берите растения, с признаками гниения и повреждения насекомыми.
- Высушить травы в сухом темном помещении, лучше в подвешенном состоянии, связав в пучки. Можно и разложить сбор на бумагу или ткань, но тогда его нужно регулярно ворошить и переворачивать.
-
Измельчить травы на фрагменты размером не более 1Х1 см для сохранения целебных свойств и аромата. Не делайте из них подобие порошка!
- Расфасовать полученное сырье в стеклянные банки, закрыть плотными крышками. Наклеить на банки этикетки, указав дату сбора, поскольку сроки хранения трав разные. Мята, чабрец, полынь, крапива, донник, листья смородины годны 2 года. Зверобой, бессмертник, мать-и-мачеху необходимо использовать в течение 3 лет. Ромашка, зверобой, таволга годны 4 года.
-
Перед запариванием в бане травы поместить в тканевый мешочек. Для его изготовления можно использовать хлопок, ситца или старые вафельные полотенца. Наполненные мешочки зафиксировать завязками.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили. Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Примеры применения
Первый случай («насильственное» явление): кипячение воды.
Воду доводят до кипения в кастрюле под давлением в одну атмосферу. В этих условиях температуры и давления мы имеем:
- p sat_eau > p totale_atmosphère > p partielle_eau .
В этом случае подача энергии к поддону вызвала повышение температуры жидкой воды, и, таким образом, давление насыщения воды также увеличилось. Этот факт приводит к образованию пузырьков пара, которые увеличивают парциальное давление воды в газообразном состоянии в атмосфере, в идеале до тех пор, пока последнее давление не достигнет уровня давления насыщения воды (или, что, очевидно, является общим случае, пока сковорода не опустеет).
Вариант первого случая : кипячение пропана и / или бутана или смеси типа СУГ .
Во флаконе, хранящемся при комнатной температуре ( 20 ° C ), заключено одно чистое тело в газообразной форме. В случае, если при этой температуре давление насыщенного пара этого газа больше, чем внешнее атмосферное давление, можно откачивать газ из баллона без дополнительной помощи (насоса). Предполагая, что определенное количество этого газа будет забрано, когда баллон будет повторно закрыт, мы будем иметь:
- p sat_gaz > p partielle_gaz = p totale_gaz .
Фактически, в этой баллоне нет другого газа, кроме того, который находится в жидкой форме, поэтому его «парциальное» давление также является общим давлением. Поэтому, чтобы восстановить равновесие, кипячение спонтанно оседать , пока давление в бутылке не достигнет насыщения давления паров этого газа до 20 ° C .
Второй случай : испарение лужи на солнце .
В этих условиях температуры и давления давление насыщенного пара воды больше, чем парциальное давление водяного пара в атмосфере, но ниже, чем общее атмосферное давление.
- p totale_atmosphère > p sat_eau > p partielle_eau .
Есть испарение .
Третий случай : дождь.
В этих условиях температуры и давления давление насыщенного пара воды ниже, чем парциальное давление водяного пара в атмосфере, и, следовательно, обязательно ниже, чем общее атмосферное давление.
- p totale_atmosphère > p partielle_eau > p sat_eau .
Происходит изменение состояния и конденсация водяного пара в капли дождя.
Смесь чистых веществ
Закон Рауля регулирует приблизительно давление насыщенного пара жидких смесей.
Рассмотрим однородную смесь двух газов в резервуаре: энергия теплового перемешивания больше, чем разница в потенциальной энергии силы тяжести, и из-за предположения об однородности расслоение отсутствует. При таком предположении состав смеси постоянен от начала до конца розыгрыша. При заданной и постоянной температуре вытяжки испарения двух газов будут происходить в пропорциях, изменяющихся в зависимости от давления вытяжки, что будет изменять состав отбираемой смеси. Газ с самым высоким давлением насыщения сначала будет иметь более высокую долю, потому что в равновесии его парциальное давление должно достигнуть давления насыщенного пара. Если последний выше, чем у другого газа, его парциальное давление также будет больше. По мере того, как давление в баллоне уменьшается, в конечном итоге произойдет падение ниже уровня давления насыщенного пара, уровня парциального давления одного газа, а затем и другого газа, следовательно, повторная конденсация. Баллоны со смесью газов имеют заданное значение температуры хранения, чтобы гарантировать, что состав эффективно отведенного газа действительно соответствует номинальному составу, в предположении, что температура отвода является температурой хранения. Если перед откачкой предписано довести смесь до определенной температуры, для которой известны пропорции отводимых газов, тогда температуру хранения можно выбрать произвольно.
Взрывная декомпрессия
В случае корпуса, содержащегося в герметичном корпусе, взрыв-кипение (или утечка ) может произойти при разрыве корпуса, когда:
- в условиях температуры и внешнего давления тело находится в газообразном состоянии;
- давление выше в корпусе, который поддерживает часть тела в жидкой форме.
Различия между испарением и кипением
Основное отличие между испарением и кипением заключается в том, как происходит переход из жидкости в пар.
Испарение происходит при любой температуре и давлении. Во время испарения, отдельные молекулы жидкости получают достаточно энергии для преодоления притяжения друг к другу и переходят в парообразное состояние.
Кипение, с другой стороны, происходит только при определенной температуре, называемой температурой кипения. Когда жидкость достигает этой температуры, ее молекулы получают достаточно энергии, чтобы эффективно преодолеть силы притяжения друг к другу и образовать пар. В процессе кипения появляются пузырьки пара, которые всплывают на поверхность жидкости.
Другое отличие между испарением и кипением связано с давлением. Испарение происходит при любом давлении, в то время как для кипения требуется определенное давление, которое зависит от температуры. При достижении температуры кипения, давление насыщенного пара становится равным атмосферному давлению.
Таким образом, испарение и кипение — это два разных процесса перехода вещества из жидкого состояния в парообразное. Испарение происходит при любых условиях, в то время как кипение происходит только при определенной температуре и давлении.
Температура и процесс перехода
Температура играет важную роль в процессе перехода жидкости в пар. Когда жидкость нагревается, ее молекулы начинают двигаться быстрее и разрываются интермолекулярные связи, переходя из фазы жидкости в фазу пара. Этот процесс называется кипением и происходит при определенной температуре, которая называется температурой кипения.
Температура кипения зависит от давления воздуха над жидкостью. При повышении давления температура кипения увеличивается, а при уменьшении давления — уменьшается. Например, на высокогорных плато, где давление воздуха ниже, жидкость будет кипеть при более низкой температуре, чем на уровне моря.
Отличие парообразования от кипения заключается в том, что парообразование происходит при любой температуре, а кипение — только при определенной. Когда жидкость нагревается, ее молекулы начинают переходить в фазу пара, но при этом они не образуют пузырей и не создают давление. Парообразование происходит на поверхности жидкости, а не во всем объеме, как при кипении.
Количество вещества и поверхность испарения
Переход вещества из жидкого состояния в газообразное происходит через процесс испарения. Этот процесс существенно отличается от кипения.
При испарении частицы жидкости переходят в пар только с поверхности жидкости. Это связано с тем, что только на поверхности молекулы могут преодолеть притяжение друг к другу и перейти в газообразное состояние. Чем больше поверхность испарения жидкости, тем быстрее происходит испарение.
Количество испарившихся частиц зависит от температуры и давления. При повышении температуры и давления количество испаряющихся частиц увеличивается, что вызывает увеличение скорости испарения.
В случае с кипением, испарение происходит не только с поверхности жидкости, но и с ее объема. Кипение происходит при достижении определенной температуры, называемой температурой кипения. При кипении давление пара над жидкостью равно внешнему давлению. Благодаря этому кипение происходит при постоянной температуре и не зависит от количества вещества в сосуде.
Таким образом, фазовый переход от жидкости к пару может происходить через процесс испарения или кипения. При испарении частицы переходят в пар только с поверхности жидкости, а при кипении испарение происходит с поверхности и объема жидкости, что вызывает увеличение количества испарившихся частиц.
См. также
- Гигрометр Wikipedia.org
- Измерители влажности воздуха и газов (гигрометр ВИТ, гигрометр электронный, гигрометр психометрический …)
- Относительная влажность Wikipedia.org
- Психрометр Wikipedia.org
Литература
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-203.
- Жилко В.В. Физика: Учеб. пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. — Мн.: Нар. асвета, 2002. — С. 194-203.
- Открытая Физика
Как образуется насыщенный и ненасыщенный пар
Но вернемся к парообразованию. Мы продолжим экспериментировать и нальем жидкость – воду, например, в открытый сосуд, а к нему подсоединим манометр. Невидимое глазу, в сосуде происходит испарение. Все молекулы жидкости находятся в непрерывном движении. Некоторые движутся так быстро, что их кинетическая энергия оказывается сильнее той, что связывает молекулы жидкости вместе.
Покинув жидкость, эти молекулы продолжают хаотически двигаться в пространстве, подавляющее их большинство рассеивается в нем – так образуется ненасыщенный пар
. Лишь небольшая их часть возвращается обратно в жидкость.
Если закроем сосуд, молекул пара постепенно будет становиться все больше. И все больше их будет возвращаться в жидкость. При этом будет увеличиваться давление пара. Это зафиксирует подсоединенный к сосуду манометр.
Спустя какое-то время число молекул, вылетающих из жидкости и возвращающихся в нее, сравняется. Давление пара перестанет изменяться. В результате насыщения пара
установится термодинамическое равновесие системы жидкость-пар. То есть испарение и конденсация будут равны.
Влажность
Одним из параметров, характеризующих бинарную (двойную) систему, состоящую из воздуха водяного пара, является влажность. Влажность воздуха — характеристика содержания водяного пара в воздухе. Различают абсолютную влажность и относительную влажность.
Абсолютная влажность — параметр, характеризующий воздух, содержащий водяной пар, численно равный плотности водяных паров, содержащихся в воздухе. Обозначение — , размерность — [кг/м ]. Формульно:
- где
- — абсолютная влажность,
- — плотность водяного пара.
Работа с абсолютной влажностью, по сути, является работой с плотностью газа. Плотность легче всего искать через определение (2) и уравнение Менделеева-Клапейрона (3):
- где
- — давление пара,
- — объём пара,
- — химическое количество пара,
- — температура пара,
- м *кг*с *К *Моль — газовая постоянная.
Выделим из (2) массу ( ) и воспользуемся определением химического количества вещества ( ). Подставим это всё в (3):
Таким образом, уравнение (4) наиболее удобно для расчёта абсолютной влажности. Главное помнить, что все параметры, входящие в уравнение (3) и (4), — это параметры, характеризующие только жидкую часть газа (водяной пар в нём). Если температура и объём для пара совпадает с теми же параметрами для воздуха, то давление пара и давление воздуха, в общем случае, различны. Для работы с ними используется закон Дальтона в частном виде:
- где
- — давление суммарного газа в баллоне,
- — парциальное (отдельное) давление пара,
- — парциальное (отдельное) давление воздуха.
Относительная влажность — параметр, характеризующий воздух, содержащий водяной пар, численно равный отношению плотности водяного пара в данном воздухе к плотности насыщенного водяного пара или отношению давления водяного пара в данном воздухе к давлению насыщенного водяного пара. Обозначение — или , размерность — безразмерная. Формульно:
- где
- — относительная влажность,
- , — давление и плотность текущего пара.
- , — давление и плотность насыщенного пара при данной температуре.
Мы только что ругнулись словом «насыщенный», давайте разберёмся с ним.
Рис. 1. Насыщенный пар
Представим себе замкнутый сосуд, в который налили воду, при этом над водой — чистый воздух (рис. 1.1). Вода начинает испаряться (переходить из жидкой фазы в газообразную) (рис. 1.2). В какой-то момент число частиц в воздухе становится значительным и газ конденсируется (переходит из газообразной фазы в жидкую) (рис. 1.3). Этот процесс изначально достаточно медленный, и испаряющихся молекул намного больше, чем конденсирующихся. Однако со временем скорость конденсации сравнивается со скоростью испарения, что говорит о том, что количество молекул воды в парообразном состоянии над газом одинаково. Т.к. количество молекул одинаково, то и давление над жидкостью одинаково. Доказывается, что это давление (а также и плотность) есть величина постоянная для любых объёмов сосудов и зависит только от температуры пара. Назовём эти параметры давлением насыщенного пара при данной температуре ( ) и плотностью насыщенного пара при данной температуре ( ). Обе величины табличные. Воздух, в котором давление пара равно давлению насыщенного пара при данной температуре, считаем воздухом со 100% влажностью.
Тогда поиск относительной влажности достаточно прост: используя текущие параметры пара и зная соответствующие параметры насыщенного пара при данной температуре, просто делим первое на второе и получаем ответ. Другой вариант таких работ с относительной влажностью — это поиск текущего давления, исходя из влажности пара:
Вывод: относительная и абсолютная влажности, по сути, являются параметрами пара, которые рассчитываются, исходя из состояния газа. Если эти параметры даны, то можно использовать (7).
Зависимость давления насыщенного пара от температуры.
Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением р 0
эта зависимость выражается равенством:
p 0 =nkT.
Так как давление насыщенного пара не зависит от объема, то, следова-тельно, оно зависит только от температуры.
Экспериментально определенная зависимость p 0 (T)
отличается от зави-симости (p 0 =nkT
) для идеального газа.
С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального га-за (участок кривой АВ
на рисунке). Это становится особенно очевидным, если провести изохору через точку A
(пунктирная прямая). Происходит это потому, что при нагревании жидкости часть ее превращается в пар, и плотность пара растет. Поэтому, согласно формуле (p 0 =nkT
), давление насы-щенного пара растет не только в результате повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. Главное различие в поведении идеального газа и насыщенного пара заключается в из-менении массы пара при изменении температуры при неизменном объеме (в закрытом сосуде) или при изменении объема при постоянной температуре. С идеальным газом ничего подобного происходить не может (молекулярно-кинетическая теория идеального газа не предусматривает фазового перехода газа в жидкость).
После испарения всей жидкости поведение пара будет соответствовать поведению идеального газа (участок ВС
кривой на рисунке выше).
Температура и давление насыщенного пара
Температура насыщенного пара устанавливается на точке кипения, которая зависит от давления. При повышении давления, температура кипения увеличивается, а при снижении давления, температура кипения снижается. Это объясняет, почему вода кипит при разных температурах на различных высотах над уровнем моря.
Давление насыщенного пара является давлением насыщенных паровой и конденсированной фазы, которые находятся в равновесии. Давление насыщенного пара также зависит от температуры. При повышении температуры, давление насыщенного пара возрастает, а при снижении температуры, давление насыщенного пара уменьшается.
Значение температуры и давления насыщенного пара имеет практическое применение в различных отраслях физики и техники. Например, для определения точки кипения жидкости, необходимо знать температуру и давление насыщенного пара данной жидкости. Также, в вычислительной физике, значения температуры и давления насыщенного пара используются для моделирования фазовых переходов и расчетов термодинамических свойств вещества.
Насыщенный пар — что это такое, определение
Насыщенным паром называется пар, для которого характерно термодинамическое равновесие с жидкостью (или твердым телом), имеющей идентичный состав.
Если говорится, что в опытах используется водяной насыщенный пар, то это значит, что он находится в термодинамическом равновесии с плоской поверхностью жидкости либо льда.
Чтобы понять механизм перехода молекул жидкости в воздух, вспомним о трех агрегатных состояниях веществ. Среди них:
- твердое;
- жидкое;
- газообразное.
Разницу между ними обуславливает строение молекулярной решетки веществ, т.е. расположение молекул относительно друг друга. При обычных внешних условиях агрегатное состояние вещества — свойство стабильное. Однако когда внешние условия меняются, в т.ч. когда внутренняя энергия вырастает, возможны различные фазовые переходы. Причиной этому могут послужить, например, нагревание, охлаждение.
Фазовый переход, при котором вещество переходит из жидкого состояния в газообразное, носит название парообразования.
Он может происходить двумя вариантами:
В первом случае это происходит при поглощении энергии, т.е. телу необходимо подвести теплоту. Это ведет к увеличению внутренней энергии, способности молекул разорвать межмолекулярные связи и покинуть поверхность жидкости.
Чем отличается от ненасыщенного
В отличие от насыщенного пара, для ненасыщенного характерно:
- Меньшие значения таких параметров, как плотность и давление. Чем менее пар насыщен, тем они меньше. Данное правило работает при условии, что температура не меняется.
- Справедливость закона Бойля-Мариотта (при постоянных температуре и массе объем увеличивается/уменьшается так же интенсивно, как давление). Давление обратно пропорционально объему. Насыщенный пар, имеющий максимальную плотность и давление (Т постоянна), не обнаруживает зависимости между давлением и объемом.
- При сохраняемом объеме плотность не зависит от температуры, поэтому объем будет постоянным при неизменности плотности. Для насыщенного пара характерно, что плотность меняется при изменении температуры.
- При постоянном объеме справедлив закон Шарля: увеличение температуры ведет к такому же увеличению давления. Зависимость носит линейный характер. Насыщенный пар характеризуется тем, что давление растет интенсивнее при увеличении температуры — зависимость экспоненциальная.
Насыщенный пар никогда нельзя рассматривать без жидкости, с поверхности которой он испаряется. Это так называемая 2-х компонентная система, не подчиняющаяся основным газовым законам.
Измерение влажности воздуха
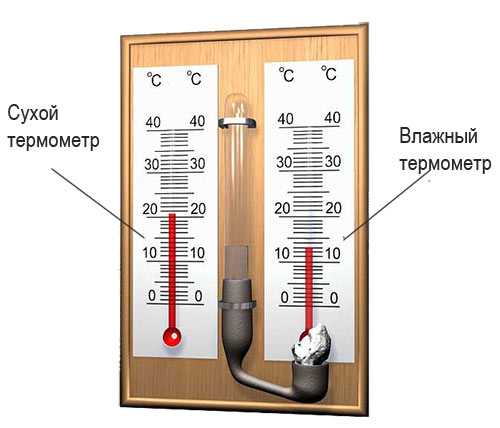
С помощью психрометра фиксируют разницу температур двух термометров – сухого и влажного. По этой разнице и температуре сухого термометра устанавливают влажность воздуха по психрометрической таблице:
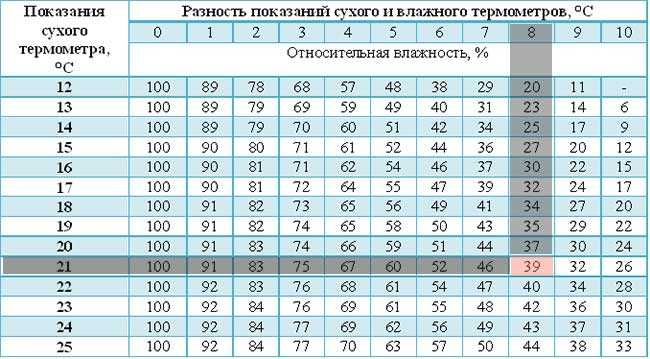
Действие волосного гигрометра основано на способности обезжиренного человеческого волоса изменять свою длину в зависимости от влажности воздуха.
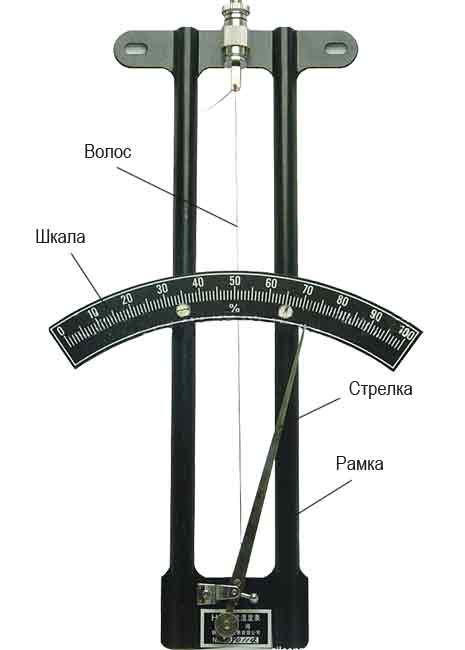
Волос соединяется со стрелкой прибора, шкала которого градуируется в процентах относительной влажности.
С помощью конденсационного гигрометра измеряют точку росы – температуру, до которой необходимо охладить воздух, чтобы содержащийся в нем водяной пар, остывая, стал насыщенным.

Начиная с этой температуры, охлаждение воздуха сопровождается появлением капелек росы на зеркальном сосуде, температуру которого понижают, прокачивая грушей воздух через легкокипящую жидкость.
В настоящее время нашли широкое применение как стрелочные, так и электронные цифровые гигрометры с жидкокристаллическим экраном.

Определенную влажность воздуха нужно поддерживать в библиотеках, музеях для лучшего сохранения книг, картин и других экспонатов. Для уменьшения электризации нитей в ткацких цехах создают высокую влажность. Строгий контроль влажности ведется в кондитерских цехах.
Вопросы для самоконтроля по блоку «Реальные газы»
- Что называют испарением? Конденсацией?
- Укажите причины, от которых зависит скорость испарения жидкости?
- Как изменяется внутренняя энергия жидкости при ее испарении?
- Чем отличается кипение жидкости от ее испарения?
- Опишите процессы, протекающие в закрытом с жидкостью сосуде. Что такое динамическое равновесие?
- Какой пар называют насыщенным?
- Почему давление насыщенного пара не зависит от объема, в котором он находится?
- Нарисуйте и объясните изотерму реального газа.
- Изобразите графически и объясните зависимость давления насыщенного пара от температуры при постоянном давлении.
- Что понимают под влажностью воздуха?
- Что такое абсолютная влажность воздуха? В каких единицах ее выражают?
- Что называют относительной влажностью воздуха?
- Что такое точка росы?
- С помощью каких приборов определяют влажность воздуха?
Давление насыщенного пара на фазовой диаграмме
Фазовая диаграмма «обычного» вещества и воды ( аномалия плотности )
На фазовой диаграмме давление насыщенного пара представляет собой значение давления вдоль границы раздела фаз, отмеченной здесь черным цветом, между газовой фазой и соответствующей твердой или жидкой фазой. Поэтому эта линия границы раздела фаз также называется кривой давления пара или кривой давления насыщенного пара . Для фазового равновесия газ-твердые тела давление насыщенного пара также называется давлением сублимации, а для фазового равновесия газ-жидкость оно также называется давлением кипения . Здесь следует отметить, что при температурах выше критической точки больше нет жидкой фазы и, следовательно, нет давления насыщенного пара. Кроме того, фазовая граница между твердым телом и жидкостью, так называемая кривая плавления, не играет роли для давления насыщенного пара.







![§ 33. испарение жидкостей. пары [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](http://meridian-complex.ru/wp-content/uploads/5/6/6/5667dd2cd26de6e890c9bd4488cc76f5.jpeg)














![Сухой пар [влажный, свежий] что это такое, свойства и виды](http://meridian-complex.ru/wp-content/uploads/5/9/c/59c2fb11c535fe62563bc1eef887de15.jpeg)







