Давление насыщенного водяного пара
Пар – агрегатное состояние воды в виде газообразного состояния вещества; эта фаза может превращаться в жидкость или в твердое вещество того же вещества. Появление пара из твердой фазы называется испарением или испарением. Обратный процесс преобразования называется конденсацией. Насыщенный пар представлен в виде пара, достигшего определенного равновесия с жидкостью. Возьмите сосуд, закройте его и поставьте при постоянной температуре. В сосуде будет происходить испарение, распределение кинетической энергии при движении тепла. При испарении количество молекул увеличивается. Концентрация вещества в парообразном состоянии при испарении достигает определенной величины, когда количество молекул, возвращающихся в жидкость, равно числу молекул, покидающих ее.
Равновесие между испарением и конденсацией становится динамическим. Пар, образующийся в этом случае, называется насыщенным паром. Если пар имеет давление ниже давления насыщения, его называют ненасыщенным. Испарение насыщенного пара может происходить как над водой, так и над льдом. В этом случае тоже существуют определенные формулы. Для достижения состояния полного насыщения воздух должен поглотить достаточное количество водяного пара, которое зависит как от температуры, так и от давления. Давление насыщенного пара – это максимальное парциальное давление водяного пара.
Типичные ошибки при расчете массы пара
- Неверное определение начальных данных: чтобы правильно рассчитать массу пара, необходимо точно знать начальную температуру и давление вещества.
- Ошибки при выборе формулы: существует несколько формул для расчета массы пара в зависимости от известных параметров. Неправильный выбор формулы может привести к неверному результату.
- Недостаточно точные значения констант: при расчете массы пара необходимо учитывать различные физические константы, такие как молярная масса и универсальная газовая постоянная. Несоответствующие значения констант также могут привести к ошибке в расчетах.
- Неучтенные факторы, такие как потери энергии или изменение состояния вещества: при расчете массы пара нужно учитывать все факторы, которые могут повлиять на результата, включая потери энергии и изменения состояния вещества.
- Ошибки округления: при округлении промежуточных результатов могут возникнуть ошибки, которые могут влиять на окончательный результат расчета массы пара.
Расчет степени насыщенности и удельного объёма водяного пара
Задача 37.
Водяной пар при атмосферном давлении имеет температуру t = 126,09 С. Определить степень его насыщенности и удельный объем.Решение:
По таблицам теплофизических свойств водяного пара находим, что температуре t = 126,09 С соответствует давление насыщения Рн = 2,4 . 10-5 Па. По формуле: = Рi/Рн, где
ф — степень насыщенности; Рi — давление водяного пара, 101325 Па; Рн — давление насыщенного пара при заданной температуре.
Тогда
= (1,01325 . 10-5)/(2,4 . 10-5) = 0,422.
Удельный объем пара рассчитаем по формуле:
Рi . vi = Ri. T, где
Ri – газовая постоянная водяного пара, равная 461,58 Дж/(кг . К); T – температура пара, К.
Тогда
vi = (Ri. T)/Рi = /(1,01325 . 10-5) = 1,818 м3/кг.
Ответ: = 0,422; vi = 1,818 м3/кг.
Уравнение Клайперона – Клазиуса
Еще одно применимое уравнение для разных агрегатных состояний. Чаще употребление относится к процессам перехода воды в парообразное состояние, но и при переходе твердого тела в жидкость уравнение уместно. Клейперон разработал определенную зависимость между температурой пара, объемом и теплотой в 1834 году, в честь чего уравнение было названо так. Его используют для определения теплоты плавления, сублимации и парообразования. Например, цикл Карно признан одним из методов решения такого уравнения. Цикл определяется как abcd, где давление dp, а температура dT. Насыщение будет определяться как ab и cd или как изобарное и изотермическое. Если поместить точку а на нижнюю границу кривой, а точку b на верхнюю, то КПД цикла будет рассчитываться по следующей формуле nt=dl/ql=T1-T2/T1.
Водяной пар, как газообразное состояние воды, имеет свои свойства и применим в различных областях, рассчитывается с помощью формул, диаграмм и уравнений. Превращение водяного пара в другие агрегатные состояния – увлекательный и интересный процесс, который также существует в природе и изучается в школах и высших учебных заведениях.
Как использовать формулу для расчета молярной массы насыщенного пара?
Для расчета молярной массы насыщенного пара можно использовать следующую формулу:
- Определите количество газа в граммах, которое находится в насыщенном паре. Это можно сделать, зная его объем.
- Рассчитайте количество вещества газа в молях. Используйте формулу n = m/M, где n — количество вещества в молях, m — масса вещества в граммах, а M — молярная масса вещества в г/моль.
- Найдите молярную массу газа, разделив массу газа в граммах на количество вещества газа в молях.
Например, предположим, что у нас есть насыщенный пар воды с массой 18 г и объемом 22.4 литра при стандартных условиях. Чтобы найти молярную массу воды, мы можем использовать формулу:
Mолярная масса (в г/моль) = Масса вещества (в г) / Количество вещества (в моль)
Применяя эту формулу, мы получим:
Mолярная масса воды = 18 г / 1 моль
Расчет показывает, что молярная масса воды составляет 18 г/моль.
Таким образом, формула позволяет нам определить молярную массу насыщенного пара, используя массу вещества и количество вещества в молях.
Абсолютная влажность
Влажность можно измерять несколькими способами.
Во-первых, водяной пар — это такой же газ, как и все прочие в воздухе, а значит, его можно характеризовать парциальным давлением и измерять в паскалях. Напомним, что парциальным называется такое давление газа, которое этот газ бы имел, если из рассматриваемого объёма удалили бы все остальные газы. Для водяного пара парциальное давление составляет от 10 до 100 паскалей (в жарком климате может доходить до 300 паскалей).
Во-вторых, водяной пар легко конденсируется в обычную воду, следовательно, влажность можно охарактеризовать массой пара, находящейся в воздухе и измерять в граммах на кубометр. Как правило, в обычных условиях в кубометре воздуха содержится от единиц до десятков грамм водяного пара.
Эти два способа измерения влажности эквивалентны, и связь между ними легко получить из уравнения Менделеева-Клапейрона:
$$p={\rho\over M}RT$$
где:
- $p$ — парциальное давление водяного пара;
- $\rho$ — масса водяного пара в воздушном объёме (плотность);
- $M$ — молярная масса воды;
- $R$ — универсальная газовая постоянная;
- $T$ — абсолютная температура.
Влажность, измеряемая данными методами, называется абсолютной, поскольку она показывает непосредственно количество воды в воздухе. Показатель абсолютной влажности полезен, например, при осушении воздуха, когда каждый грамм вещества-поглотителя может впитать определённое количество воды, поэтому для расчетов, на сколько кубометров воздуха хватит поглотителя, используется показатель абсолютной влажности.
Рис. 2. Абсолютная влажность.
Формула для расчета массы пара
Для расчета массы пара необходимо использовать формулу, которая основывается на физических законах и свойствах вещества. Формула для расчета массы пара выглядит следующим образом:
- Сначала необходимо определить начальную температуру пара (T1) и конечную температуру пара (T2) в градусах Цельсия или Кельвина.
- Затем нужно определить удельную теплоту парообразования (Л) в кДж/кг.
- После этого необходимо вычислить массу пара (m) с использованием формулы:
Полученная масса пара будет выражена в килограммах (кг).
Пример:
- Начальная температура пара (T1) = 100 градусов Цельсия
- Конечная температура пара (T2) = 200 градусов Цельсия
- Удельная теплота парообразования (Л) = 2,5 кДж/кг
Для расчета массы пара по формуле:
Таким образом, масса пара составит 250 килограмм.
Давление пара
Пускай имеется цилиндр, в котором находится жидкость в равновесии с насыщенным паром. Будем считать, что температура не меняется. При сжатии насыщенного пара, находящегося в равновесии с жидкостью, сначала равновесие будет нарушено. Плотность пара увеличится, и из газа в жидкость будет переходить молекул больше, чем из жидкости в газ, так как количество испаряющихся молекул зависит только от температуры, а сжатие пара на это не влияет. Этот процесс выравнивания потоков молекул будет происходить до установления динамического равновесия, и достижения (концентрации молекул) первоначального значения плотности пара (концентрации молекул).
p
$ p = n * k* T $ (2),
где: n — концентрация молекул газа, T — температура, k — постоянная Больцмана.
Следовательно, давление насыщенного пара не зависит от занимаемого им объема.
Рис. 1. Давление насыщенного пара не зависит от занимаемого им объема.
Определение и величина
Величина молярной массы насыщенного пара влияет на его плотность и общие свойства. Она позволяет определить количество вещества, содержащееся в определенном объеме пара.
Рассчитать молярную массу насыщенного пара можно, зная массу газа и его количество молей. При этом используется уравнение идеального газа:
- Вычислить количество молей газа по формуле: количество молей = масса газа / молярная масса.
- Зная количество молей и массу газа, определить молярную массу по формуле: молярная масса = масса газа / количество молей.
Молярная масса насыщенного пара позволяет провести различные расчеты и анализы, связанные с газами в насыщенном состоянии. Она широко используется в физике, химии, технике и других научных дисциплинах.
Какой цвет: белый или прозрачный
Многие люди задаются вопросом: водяной пар белый или прозрачный? Можно его увидеть?
В повседневной жизни при кипении воды в чайнике мы часто видим белый дымок, который вырывается из носика. Некоторые люди считают его паром. На самом деле – это туман (результат конденсации водяного пара).
Настоящий пар невидим глазу, он прозрачный, безвкусный. Не имеет постоянной формы, запаха.
Основное содержание наблюдается в нижних слоях атмосферы (тропосфера). Пар может переходить в жидкое состояние. Данное явление мы часто наблюдаем в повседневной жизни, когда оконные стекла в комнате запотевают. Это значит, что водяной пар в тёплом воздухе комнаты коснулся холодного стекла, сгустился и превратился в мельчайшие капельки воды. Явление называют конденсацией.
Водяной пар принимает непосредственное участие в круговороте воды в природе. С его помощью образуются: облака, тучи, туман. Наибольшее скопление наблюдается в тропосфере.
В настоящий момент пар часто используют для бытовых нужд и производства. Среди наиболее известных устройств с его применением можно отнести:
- утюги;
- паровозы;
- пароходы;
- паровые котлы;
- с его помощью вращают турбины генераторов на электростанции, тушат пожары.
Практическое применение знания о массе пара
Понимание массы пара имеет практическое применение в различных областях жизни. Ниже приведены несколько примеров, где знание о массе пара может быть полезно:
| Область применения | Пример |
|---|---|
| Энергетика |
Масса пара используется для расчета энергетической эффективности котельных установок на паре. Зная массу пара, можно определить его удельную теплоемкость и вычислить количество тепла, которое можно получить при сгорании определенного количества топлива |
| Авиация |
В авиации знание о массе пара позволяет определить, сколько топлива необходимо для запуска двигателей самолета. Зная массу пара, можно также рассчитать грузоподъемность самолета и оптимизировать распределение веса на борту |
| Медицина |
Масса пара используется при проведении анализов и диагностики в медицине. Например, при измерении массы тела пациента или при расчете дозировки лекарственных препаратов |
| Производство и строительство |
Масса пара играет важную роль в производстве и строительстве, где используется пар для технологических процессов. Знание о массе пара позволяет правильно выбирать и настраивать оборудование, оптимизировать процессы и повышать эффективность производства |
Это только несколько примеров применения знания о массе пара. В реальном мире масса пара является важным параметром, который может быть использован во многих областях нашей жизни.
Зависимость давления насыщенного пара от температуры
Из формулы (2) следует, что давление насыщенного пара pнп зависит только от температуры.
Рис. 2. Зависимость давления насыщенного водяного пара от температуры.
Из экспериментальных графиков видно, что зависимость pнп(T) не линейна (не прямо пропорциональна). С ростом Т давление pнп растет быстрее, чем давление идеального газа. Дело в том, что давление насыщенного пара растет также за счет увеличения концентрации молекул (плотности) пара, так как с ростом температуры растет число испарившихся молекул. В идеальном газе такой механизм отсутствует — давление в нем растет только за счет роста кинетической энергии молекул.
Для большинства веществ экспериментально получены значения давлений насыщенных паров при различных температурах. Эти данные можно найти в справочниках или на соответствующих интернет-ресурсах. В качестве примера ниже приведена такая таблица для воды и ртути.
Таблица зависимости давления насыщенных паров от температуры для воды и ртути
|
Температура,С |
Давление паров воды, мм.рт.ст. |
Давление паров ртути, мм.рт.ст. |
Температура,С |
Давление паров воды, мм.рт.ст. |
Давление паров ртути, мм.рт.ст. |
|
4,58 |
0,00021 |
100 |
760 |
0,28 |
|
|
20 |
17,5 |
0,0013 |
120 |
1489 |
0,76 |
|
40 |
55,3 |
0,0065 |
140 |
2711 |
1,85 |
|
60 |
149 |
0,026 |
200 |
11660 |
17,2 |
|
80 |
355 |
0,092 |
300 |
64450 |
245 |
|
90 |
526 |
0,16 |
374 |
165530 |
1100 |
На предметах, принесенных в помещение с мороза образуются капли воды, “выпадает роса”. Это происходит из-за насыщения водяными парами. Также объясняется запотевание оконных стекол в наших квартирах. Образование капелек конденсата связано с термином “точка росы”. Точка росы — это температура, при которой водяной пар в охлажденном воздухе становиться насыщенным и начинает конденсироваться.
Рис. 3. Точка росы.
Что мы узнали?
Итак, мы узнали, что пар, находящийся в равновесии с жидкостью называется насыщенным. Давление насыщенного пара не зависит от занимаемого им объема. С ростом температуры давление насыщенного пара растет.
-
/5
Вопрос 1 из 5
Примеры решения задач по нахождению массы пара
При решении задач по нахождению массы пара необходимо учитывать законы сохранения массы и энергии.
Пример 1:
Для решения задачи по нахождению массы пара мы можем использовать формулу:
m = m1 + m2
где m — масса пара, m1 — масса вещества, превращающегося в пар, и m2 — масса воды.
Например, если нам дана масса воды равная 500 г и масса вещества, превращающегося в пар, равная 200 г, то общая масса пара будет:
m = 500 г + 200 г = 700 г
Пример 2:
Для решения задачи по нахождению массы пара, если известна начальная и конечная температура вещества, можно воспользоваться формулой:
m = (Q * t) / L
где m — масса пара, Q — количество теплоты, необходимое для превращения вещества в пар, t — время, в течение которого это произошло, и L — теплота парообразования.
Например, если количество теплоты, необходимое для превращения вещества в пар, равно 1000 Дж, время равно 10 секунд, а теплота парообразования равна 500 Дж/г, то масса пара будет:
m = (1000 Дж * 10 сек) / 500 Дж/г = 20 г
Таким образом, решая задачи, связанные с нахождением массы пара, следует учитывать различные факторы, включая начальную и конечную температуру, количество теплоты и массу вещества, превращающегося в пар.
Процесс парообразования и перегрева
При испарении жидкость доводится до кипения и превращается в пар. Этот процесс изобарно-термический. Теорию состояния материи в ее совокупных фазах создал Ломоносов. Паровые электростанции работают от рабочего тела, такого как перегретый пар.
Последовательность процессов получения перегретого пара:
— изобарный;
— изобарно-изотермический;
— изобарный.
Наука быстро развивается и за последнее тысячелетие многое изменилось, появился интерес к изучению воды и различного рода явлений с ее участием. Методы уравнений начали заменяться программным обеспечением и становились все более систематизированными и автоматизированными. Диаграммы, наряду с формулами, являются наиболее важными способами детального и точного изучения процессов.
При перегреве при давлении, имеющемся в данную минуту, в момент появления сухого насыщенного пара объем и температура увеличиваются. Перегретый пар – это пар, температура которого превышает точку кипения.
Как рассчитать молярную массу насыщенного пара?
Для начала необходимо знать следующие параметры: массу вещества, температуру и давление, при которых пар насыщен. Затем можно воспользоваться следующей формулой для расчета молярной массы насыщенного пара:
M = (m * R * T) / (P * V)
где:
- M — молярная масса насыщенного пара (в г/моль);
- m — масса вещества (в г);
- R — универсальная газовая постоянная, равная примерно 8.314 Дж/(моль·К);
- T — температура (в К);
- P — давление (в Па);
- V — объем (в м³).
После подстановки значений в формулу и выполнения всех необходимых арифметических операций, можно получить значение молярной массы насыщенного пара в указанных единицах измерения.
Психрометрическая таблица
Атмосферный воздух содержит водяной пар; только громкость меняется на небольшой процент. Водяной пар характеризуется разными количествами, поэтому и составляется формула «воды». Абсолютная влажность – это количество водяного пара на кубический метр воздуха в граммах. Эластичность рассчитывается в геопаскалях, а эластичность насыщения – это максимальная эластичность. Для решения различных уравнений с паром необходимо также знать такие величины, как относительная влажность, процентное соотношение упругости пара и упругости насыщения при определенной температуре. Дефицитом влаги принято считать разницу между давлением насыщения пара и действительным значением упругости. Влажность воздуха в основном измеряют психометрически с помощью психрометра. Психрометрические измерения рассчитываются по следующей формуле: е = Е’ — А (t — t’) П.
Психрометр. Гигрометр
При понижении температуры, относительная влажность воздуха увеличивается. При некоторой температуре (точке росы) водяной пар становится насыщенным. Дальнейшее понижение температуры приводит к тому, что образующийся излишек водяных паров начинает конденсироваться в виде капелек росы или тумана.
Для определения относительной влажности воздуха, можно искусственно понизить температуру воздуха в какой-то ограниченной области до точки росы. Абсолютная влажность и, соответственно, давление водяных паров при этом останутся неизменными. Сравнивая давление водяного пара при точке росы с давлением насыщенного пара, которое могло бы быть при интересующей нас температуре, мы тем самым, найдем относительную влажность воздуха. Быстрого охлаждения можно добиться при интенсивном испарении какой-нибудь летучей жидкости. Такой метод применяют для измерении влажности при помощи конденсационного гигрометра.
Конденсационный гигрометр состоит из металлической коробочки с двумя отверстиями (рис. 6).
Рис. 6
В коробочку заливается эфир. С помощью резиновой груши через коробочку прокачивается воздух. Эфир очень быстро испаряется, температура коробочки и воздуха, находящегося вблизи нее, понижается, а относительная влажность растет. При некоторой температуре, которая измеряется термометром, вставленным в отверстие прибора, поверхность коробочки покрывается мельчайшими капельками росы. Чтобы точнее зафиксировать момент появления на поверхности коробочки росы, эта поверхность полируется до зеркального блеска, а рядом с коробочкой для контроля располагается отполированное металлическое кольцо.
В современных конденсационных гигрометрах для охлаждения зеркальца пользуются полупроводниковым элементом, принцип действия которого основан на Пельтье эффекте, а температура зеркальца измеряется вмонтированным в него проволочным сопротивлением или полупроводниковым микротермометром.
Действие волосного гигрометра основано на свойстве обезжиренного человеческого волоса изменять свою длину при изменении влажности воздуха, что позволяет измерять относительную влажность от 30 до 100%. Волос 1 (рис. 7) натянут на металлическую рамку 2. Изменение длины волоса передаётся стрелке 3, перемещающейся вдоль шкалы.
Рис. 7
Действие керамического гигрометра основано на зависимости электрического сопротивления твердой и пористой керамической массы (смесь глины, кремния, каолина и некоторых окислов металла) от влажности воздуха.
Относительную влажность определяют также с помощью психрометра.
Психрометр состоит из двух термометров, шарик одного из них обмотан тканью, нижние концы которой опущены в сосуд с дистиллированной водой (рис. 8). Сухой термометр регистрирует температуру воздуха, а влажный — температуру испаряющейся воды. Но при испарении жидкости ее температура понижается. Чем суше воздух (меньше его относительная влажность), тем интенсивнее испаряется вода из влажной ткани и тем ниже ее температура. Следовательно, разность показаний сухого и влажного термометров (так называемая психрометрическая разность) зависит от относительной влажности воздуха. Зная эту разность температур, определяют относительную влажность воздуха по специальным психрометрическим таблицам.
Рис. 8
- Гигрометр — от греч.Hygros — влажный.
- Психрометр — от греч.Psychros — холодный + Metreo — измеряю
Парциальное давление
Атмосферный воздух состоит из водяного пара и смеси различных газов. Давление, которое производил бы только водяной пар, при исключении всех других элементов называют парциальным давлением (упругостью).
Формула для расчета. Закон парциальных давлений газов (Закон Дальтона)
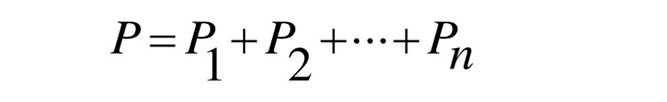 Давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
Давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
Где p1, p2, p3+pn – парциальное давления, производимое каждым газом, входящим в состав смеси.
Значение выражается в мбар или мм. ртутного столба. Отвечает за влажность воздуха, атмосферное давление.
Атмосферное давление важный показатель, который напрямую влияет на влажность воздуха, состояние людей (метеозависимых), температуру кипения.
Например, в горах при подъеме над поверхностью Земли, температура кипения воды падает, так как снижается атмосферное давление. На Эльбрусе, самой высокой вершине Европы (5642), вода закипит при 80,8 °С.
Температура
Чем выше температура воздуха, тем больше водяного пара содержится в нем.
В 1 м 3 воздуха при температуре +20 °С может содержаться 17 грамм
При Температуре -20 °С – только 1 грамм.
Масса водяного пара
Массу можно определить из уравнения Менделеева-Клапейрона.
pV = (m/M . RT), где
р — давление насыщенного водяного пара;
V – его объём;
М — молярная масса пара;
R — газовая постоянная;
Т — температура пара.
Как образуется водяной пар
Образуется двумя способами, в результате испарения и кипения. Рассмотрим более подробно каждый из них.
- Испарение. Пар поступает в атмосферу, испаряясь с поверхности водоемов, почвы, растений. В атмосфере конденсация водяного пара приводит к образованию облаков, тумана и осадков, а десублимация – снега;
- Кипение. Пар образуется по всему объему жидкости.
Испарение происходит при любой температуре, кипение — при одной, определенной для текущего давления. Когда процесс кипения начался, то, несмотря на продолжающийся подвод тепла, температура жидкости изменяется незначительно, пока вся жидкость не превратится в пар.







![§ 33. испарение жидкостей. пары [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](http://meridian-complex.ru/wp-content/uploads/c/8/8/c88e860bab1f6f78b39c738f038198c3.jpeg)














