Изотермический процесс (T=const)
Определение 10
При протекании квазипроцесса с постоянным параметром Т говорят об изотермическом процессе.
Из уравнения pV=νRT=mMRT имеем, что неизменные температура Т с количеством вещества ν – это постоянное состояние для произведения значения давления газа p на его объем V:
pV=const.
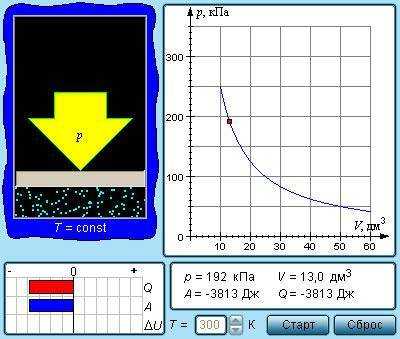
Рисунок 3.3.1. Модель изотермического процесса.
Определение 11
Изображение изотермических процессов на плоскости (p, V) предусматривает различные значения температур Т гипербол p~1V. Они получили название изотермов.
Коэффициент пропорциональности данного отношения увеличивается с ростом Т. Рисунок 3.3.2 показывает, что при меньшей Т подразумевает уменьшение V. В 1662 году было получено уравнение изотермического процесса Р. Бойлем, а позднее Э. Мариоттом в 1676 году. Отсюда и сложное его название – закон Бойля-Мариотта.
Рисунок 3.3.2. Семейство изотерм на плоскости (p, V). T3>T2>T1.
Как использовать таблицы для нахождения давления насыщенного пара
Таблицы являются прекрасным инструментом для быстрого и точного нахождения давления насыщенного пара. Для использования таблиц необходимо знать температуру и характеристики вещества, чье давление вы планируете найти.
Таблицы давления насыщенного пара построены на базе уравнения Клапейрона-Клаузиуса, которое описывает связь между давлением, температурой и объемом газа. Таким образом, таблицы содержат данные о давлении насыщенного пара при разных температурах и характеристиках вещества.
Для нахождения давления насыщенного пара в таблицах необходимо найти значение температуры в левом столбце таблицы и перейти в соответствующую строку, которая содержит характеристики вещества (например, массу, объем или давление). Искомое значение давления будет находиться в ячейке, пересекающейся со строкой и столбцом, содержащими заданные значения температуры и характеристики вещества.
| Температура, °C | Вода | Этилен | Пропан |
|---|---|---|---|
| 0,00611 | 0,0218 | 0,0151 | |
| 10 | 0,0123 | 0,0331 | 0,0236 |
| 20 | 0,0238 | 0,0483 | 0,0387 |
Пример: Найдем давление насыщенного пара воды при температуре 10°C. Из таблицы мы видим, что при этой температуре значение давления насыщенного пара воды равно 0,0123 МПа.
Вопрос-ответ
Вопрос: Какие факторы влияют на давление насыщенного пара?
Ответ: На давление насыщенного пара влияют температура, тип вещества и степень его очистки, атмосферное давление.
Вопрос: Как можно определить давление насыщенного пара в лабораторных условиях?
Ответ: Для определения давления насыщенного пара в лабораторных условиях можно использовать метод установки равновесия, где исследуемое вещество находится в равновесии с его насыщенным паром при определенной температуре.
Вопрос: Как изменить давление насыщенного пара в системе?
Ответ: Для изменения давления насыщенного пара в системе можно изменять температуру вещества или изменять количество вещества в системе. Также можно изменять атмосферное давление внешней среды.
Вопрос: Как влияет давление насыщенного пара на кипение вещества?
Ответ: Давление насыщенного пара является давлением, при котором пар и жидкость находятся в равновесии. Когда это давление равно атмосферному, происходит кипение вещества. С увеличением давления насыщенного пара температура кипения также увеличивается.
Вопрос: Как связаны давление насыщенного пара и термодинамическая устойчивость системы?
Ответ: Давление насыщенного пара является одним из параметров, характеризующих термодинамическую устойчивость системы. Если система находится в равновесии, то давление насыщенного пара определяется термодинамическими свойствами вещества. В случае нарушения равновесия, может произойти изменение давления насыщенного пара и самой системы в целом.
Главная — Советы — Узнайте, как легко и быстро найти давление насыщенного пара с нашими простыми инструкциями.
Комментарии
Екатерина
5.0 out of 5.0 stars5.0
Спасибо за полезный материал! Я давно интересуюсь термодинамикой, поэтому статья мне была очень интересна. Конечно, было бы здорово, если бы вы рассказали о различных методах измерения давления насыщенного пара и привели примеры их применения.
Maximus
5.0 out of 5.0 stars5.0
Статья была короткой и информативной. Я быстро нашел ответ на свой вопрос и теперь знаю как найти давление насыщенного пара. Спасибо!
Дмитрий
5.0 out of 5.0 stars5.0
Я всегда был заинтересован в химии и термодинамике, поэтому статья на тему поиска давления насыщенного пара была для меня очень интересна. Я бы хотел увидеть некоторые примеры расчетов и пояснения, но в целом статья была понятной и информативной. Теперь я действительно знаю, как найти давление насыщенного пара. Спасибо автору!
Анна Кузнецова
5.0 out of 5.0 stars5.0
Интересная статья, но хотелось бы больше узнать о методах измерения давления насыщенного пара.
Viper
5.0 out of 5.0 stars5.0
Я прохожу специальность механика и занимаюсь изучением всех аспектов механики и термодинамики. Эта статья на тему поиска давления насыщенного пара была для меня очень интересной и информативной. Я бы хотел увидеть больше примеров расчетов и более подробных пояснений, так как изложение иногда было слишком упрощенным. Однако, в целом статья была понятной и отличным источником знаний о давлении насыщенного пара. Я рекомендую ее всем, кто интересуется термодинамикой и ищет информацию на тему поиска давления насыщенного пара. Спасибо автору за такую полезную статью!
Kitty
5.0 out of 5.0 stars5.0
Влияние давления на насыщение паром
Давление имеет важное влияние на процесс насыщения паром. Чтобы определить, насыщен пар или нет, необходимо учитывать давление, при котором происходит насыщение
На примере воды можно проиллюстрировать влияние давления на насыщение паром. При обычных условиях, то есть при давлении атмосферы, вода начинает кипеть при температуре 100 градусов Цельсия. При этой температуре вода превращается в пар, насыщаясь им. Однако, при повышении давления, точка кипения воды также повышается. Например, при давлении 2 атмосферы, вода начнет кипеть при температуре около 120 градусов Цельсия.
Таким образом, давление играет роль в процессе насыщения паром. При достижении определенного давления, жидкость начинает переходить в паровую фазу, насыщаясь паром. Если же давление ниже необходимого значения, насыщение не происходит.
Важно отметить, что при определении насыщения паром необходимо также учитывать температуру вещества, так как она также оказывает влияние на процесс насыщения. Таким образом, для определения насыщения паром необходимо знать соответствующую комбинацию давления и температуры, при которой насыщение происходит
Эти данные могут быть представлены в виде диаграмм или таблиц, которые помогают определить, насыщен пар или нет
Таким образом, для определения насыщения паром необходимо знать соответствующую комбинацию давления и температуры, при которой насыщение происходит. Эти данные могут быть представлены в виде диаграмм или таблиц, которые помогают определить, насыщен пар или нет.
2.7.1 Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и б´ольшую сторону.
На рис. 2.16
изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный ¾хвост¿ графика это небольшое число ¾быстрых¿ молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Число молекул
Быстрые молекулы
Скорость молекул
Рис. 2.16. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т. е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости7
.
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара процесс, обратный испарению жидкости.
Насыщенный пар — что это такое, определение
Если говорится, что в опытах используется водяной насыщенный пар, то это значит, что он находится в термодинамическом равновесии с плоской поверхностью жидкости либо льда.
Чтобы понять механизм перехода молекул жидкости в воздух, вспомним о трех агрегатных состояниях веществ. Среди них:
- твердое;
- жидкое;
- газообразное.
Разницу между ними обуславливает строение молекулярной решетки веществ, т.е. расположение молекул относительно друг друга. При обычных внешних условиях агрегатное состояние вещества — свойство стабильное. Однако когда внешние условия меняются, в т.ч. когда внутренняя энергия вырастает, возможны различные фазовые переходы. Причиной этому могут послужить, например, нагревание, охлаждение.
Он может происходить двумя вариантами:
- кипением;
- испарением.
В первом случае это происходит при поглощении энергии, т.е. телу необходимо подвести теплоту. Это ведет к увеличению внутренней энергии, способности молекул разорвать межмолекулярные связи и покинуть поверхность жидкости.
При испарении молекулы жидкости переходят в газ со свободной поверхности. К примеру, недавно заваренный чай некоторое время «парит», поскольку вода недавно кипела. Испарение происходит и у жидкости обычной температуры, поскольку разница ее температуры с воздухом все-таки существует. Такое испарение менее интенсивно, однако оно не равно нулю. Кроме того, в физике существует явление диффузии и молекулы покидают поверхность жидкости, переходя в воздух, вследствие нее.
Чем отличается от ненасыщенного
В отличие от насыщенного пара, для ненасыщенного характерно:
- Меньшие значения таких параметров, как плотность и давление. Чем менее пар насыщен, тем они меньше. Данное правило работает при условии, что температура не меняется.
- Справедливость закона Бойля-Мариотта (при постоянных температуре и массе объем увеличивается/уменьшается так же интенсивно, как давление). Давление обратно пропорционально объему. Насыщенный пар, имеющий максимальную плотность и давление (Т постоянна), не обнаруживает зависимости между давлением и объемом.
- При сохраняемом объеме плотность не зависит от температуры, поэтому объем будет постоянным при неизменности плотности. Для насыщенного пара характерно, что плотность меняется при изменении температуры.
- При постоянном объеме справедлив закон Шарля: увеличение температуры ведет к такому же увеличению давления. Зависимость носит линейный характер. Насыщенный пар характеризуется тем, что давление растет интенсивнее при увеличении температуры — зависимость экспоненциальная.
Определение плотности насыщенного пара
Определение плотности насыщенного пара является важным для ряда приложений, особенно в области термодинамики, где требуется учет паровых процессов. Знание плотности насыщенного пара позволяет рассчитывать различные параметры, такие как массовый поток пара или объем парового пространства.
Плотность насыщенного пара зависит от температуры и давления. При повышении температуры плотность насыщенного пара обычно увеличивается, так как при этом молекулы пара обладают большей энергией и двигаются быстрее. При повышении давления плотность насыщенного пара также обычно увеличивается, поскольку при этом молекулы пара находятся ближе друг к другу.
Определение плотности насыщенного пара используется в различных промышленных процессах, в технике и в научных исследованиях. Знание плотности насыщенного пара позволяет проводить точные расчеты и проектировать системы, в которых пар находится в насыщенном состоянии.
Зависимость давления насыщенного пара от температуры.
Экспериментально определенная зависимость p(T) отличается от зависимости ( p
=nkT ) для идеального газа.
С повышением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (часть кривой AB на рисунке). Это становится особенно ясно, если провести изохорду через точку А (пунктирная линия), поскольку при нагревании жидкости часть ее превращается в пар, и плотность пара увеличивается. Поэтому, согласно формуле ( p=nkT ), давление насыщенного пара увеличивается не только из-за повышения температуры жидкости, но и из-за увеличения концентрации молекул (плотности) пара. Основное различие в поведении идеального газа и насыщенного пара заключается в изменении массы пара при изменении температуры при неизменном объеме (в закрытом сосуде) или изменении объема при постоянной температуре. Ничего подобного не может произойти с идеальным газом (молекулярно-кинетическая теория идеального газа не предсказывает фазовый переход от газа к жидкости).После испарения всей жидкости поведение пара соответствует поведению идеального газа (часть BC кривой на рисунке выше).
Если вПоэтому молекулы постоянно уходят и возвращаются. Если молекул вылетает больше, чем возвращается, жидкость испаряется. Если, с другой стороны, молекул возвращается больше, чем выходит, происходит конденсация. Если число уходящих молекул равно числу возвращающихся, то между веществом и паром существует так называемое динамическое (подвижное) равновесие. Пар, находящийся в равновесии с жидкостью (веществом), называется насыщенным паром.
Насыщенные пары, содержащие капельки жидкости, называются влажными парами, а ненасыщенные — сухими парами. Состояние сухого пара неустойчиво: при малейшем приложении тепла он частично конденсируется и становится жидкостью, а при приложении тепла превращается в перегретый пар.
Как провести анализ графика насыщенности пара
Анализ графика насыщенности пара позволяет определить, насколько пар находится в насыщенном состоянии. Насыщенный пар содержит максимальное количество возможного пара в данной температуре и давлении. Проведение анализа графика насыщенности пара помогает выявить отклонения и принять меры для оптимизации работы системы.
Для проведения анализа необходимо построить график зависимости давления от температуры. Это можно сделать с использованием специальных программ или онлайн-ресурсов. На графике будут отображены две кривые: насыщенный пар и насыщенная жидкость.
Основные признаки насыщенного пара на графике:
| Признак | Описание |
|---|---|
| Горизонтальный участок | На этом участке графика пар находится в насыщенном состоянии. Температура и давление остаются постоянными, и пар существует в равновесии с жидкостью. |
| Наклонный участок | На этом участке графика пар не находится в насыщенном состоянии. Увеличение температуры при постоянном давлении приводит к увеличению содержания пара в смеси. Наклон участка показывает, как быстро происходит увеличение давления при изменении температуры. |
Анализ графика насыщенности пара позволяет определить оптимальные параметры работы системы, такие как температура и давление. Также на основе анализа можно выявить возможные проблемы в работе системы, связанные с утечками пара, неправильной настройкой оборудования или другими факторами.
Важно помнить, что анализ графика насыщенности пара является лишь одним из инструментов для определения состояния пара. Для полноценной оценки работы системы рекомендуется использовать и другие методы и инструменты анализа
Формулы для расчета плотности насыщенного пара
Одна из наиболее распространенных формул для расчета плотности насыщенного пара основана на уравнении состояния идеального газа. В этой формуле, плотность насыщенного пара (ρ) определяется как отношение массы пара к его объему:
ρ = m/V
где m — масса пара, а V — его объем.
Если известна масса пара и его объем, можно просто подставить значения в эту формулу и вычислить плотность.
В случае, если известны другие параметры, такие как температура и давление, можно использовать другие формулы. Например, уравнение Клапейрона можно использовать для расчета плотности насыщенного пара при известной температуре и давлении:
pV = nRT
где p — давление, V — объем, n — количество вещества, R — универсальная газовая постоянная, а T — температура. Опять же, можно использовать данную формулу для расчета плотности насыщенного пара, зная значение объема и температуры.
Формулы для расчета плотности насыщенного пара могут также зависеть от конкретного вещества, с которым работает исследователь или инженер. Различные вещества имеют различные свойства парообразования и различные формулы могут использоваться для вычисления их плотности.
Важно отметить, что формулы для расчета плотности насыщенного пара могут быть сложными и требовать использования дополнительных констант и таблиц свойств веществ. Поэтому в некоторых случаях может быть целесообразно использовать специализированные программы или онлайн-калькуляторы для вычисления плотности насыщенного пара
Определение удельной энтальпии водяного пара
Задача 38.
Пар при температуре t = 85,95 С имеет удельный объем vп = 2,732 м3/кг. Определить удельную энтальпию пара.Решение:1. Находим плотность пара по формуле:
Рп = 1/vi = 1/2,732 = 0,366 кг/м3.
2. Расчет степени сухости пара
Согласно таблличным данным, температуре t = 85,95 С соответствует плотность насыщенного пара рн = 0,366 кг/м3. Поскольку рп = рн, то в задаче задан сухой пар. По формуле = Рп/Рн ) находим степень сухости пара:
= 0,366/0,366 = 1.
= 1, что соответствует сухому насыщенному пару.
3. Расчет энтальпии пара
Расчет энтальпии пара проводим по формуле:
ix = i’ * r * , где
i’ — удельная энтальпия кипящей воды; r — удельная теплота парообразования; — степень сухости влажного пара; ix — энтальпия пара.
По таблице приложения для t = 85,95 0С определяем удельную энтальпию кипящей воды и удельную теплоту парообразования ix = 359,93 кДж/кг, r = 2293,64 кДж/кг.
Тогда
ix = 359,93 . 2293,64 . 1 = 825549,8452 кДж/кг.
Ответ: ix = 825549,8452 кДж/кг.
Относительная упругость, плотность и давление перегретого пара
Задача 39.
Относительная упругость пара при температуре t = 150 С составляет ф = 80%. Определить плотность и удельную энтальпию пара.Решение:
Пар, заданный в задаче, – перегретый. По таблице приложения для температуры t = 150 С определяем давление насыщения и плотность насыщенного пара: Рн = 476000 Па, Рп = 2,547 кг/м3.
1. Расчет плотности заданного пара
Плотности заданного пара находим по формуле:
= Рi/Рн, где
Рi — плотность заданного пара; рн = плотность насыщенного пара.
Тогда
Рi = . Рн = 0,8 . 2,547 = 2,0376 кг/м3.
2. Расчет давления перегретого пара
Давления перегретого пара рассчитаем по формуле:
= Рt/Рн, где
— относительная упругость пара при заданной температуре; рп =давление насыщенияпара.
Тогда
Рt = . Рп = 0,8 . 476000 = 380800 кг/м3.
По таблице приложения находим, что такое давление является насыщенным при температуре tн = 119,7 2С. Таким образом, пар перегрет от температуры насыщения tн = 119,7 С до температуры t = 150 С. По таблице определяем удельную теплоемкость пара для этого диапазона температуры, которая оказывается равной сп = 2,114 кДж/(кг.К). По табл. 1 приложения для tн = 119,7 С находим удельную энтальпию насыщенного пара i’ = 2704,59 кДж/кг.
3. Расчет удельной энтальпии перегретого пара
По формуле [it = i’ . Сп(t -t’)] рассчитываем удельную энтальпию перегретого пара, получим:
it = 2704,59 . 2,114(150 -119,7) = 173240,34 кДж/кг.
Ответ: Рi = 2,0376 кг/м3; it = 173240,34 кДж/кг.
Молекулярная физика. Насыщенные и ненасыщенные пары.
При испарении одновременно с переходом молекул из жидкости в пар происходит и обратный процесс. Беспорядочно двигаясь над поверхностью жидкости, часть молекул, покинувших ее, снова возвращается в жидкость.
Если испарение происходит в закрытом сосуде, то сначала число молекул, вылетевших из жидкости, будет больше числа молекул, возвратившихся обратно в жидкость. Поэтому плотность пара в сосуде будет постепенно увеличиваться. С увеличением плотности пара увеличивается и число молекул, возвращающихся в жидкость. Довольно скоро число молекул, вылетающих из жидкости, станет равным числу молекул пара, возвращающихся обратно в жидкость. С этого момента число молекул пара над жидкостью будет постоянным. Для воды при комнатной температуре это число приблизительно равно 10 22 молекул за 1 с на 1 см 2 площади поверхности. Наступает так называемое динамическое равновесие между паром и жидкостью.
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным паром.
Это означает, что в данном объеме при данной температуре не может находиться большее количество пара.
При динамическом равновесии масса жидкости в закрытом сосуде не изменяется, хотя жидкость продолжает испаряться. Точно так же не изменяется и масса насыщенного пара над этой жидкостью, хотя пар продолжает конденсироваться.
Давление насыщенного пара .
При сжатии насыщенного пара, температура которого поддерживается постоянной, равновесие сначала начнет нарушаться: плотность пара возрастет, и вследствие этого из газа в жидкость будет переходить больше молекул, чем из жидкости в газ; продолжаться это будет до тех пор, пока концентрация пара в новом объеме не станет прежней, соответствующей концентрации насыщенного пара при данной температуре (и равновесие восстановится). Объясняется это тем, что число молекул, покидающих жидкость за единицу времени, зависит только от температуры.
Итак, концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема.
Поскольку давление газа пропорционально концентрации его молекул, то и давление насыщенного пара не зависит от занимаемого им объема. Давление р, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара большая его часть переходит в жидкое состояние. Жидкость занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
Зависимость давления насыщенного пара от температуры.
Для идеального газа справедлива линейная зависимость давления от температуры при постоянном объеме. Применительно к насыщенному пару с давлением р эта зависимость выражается равенством:
Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Экспериментально определенная зависимость p(T) отличается от зависимости (p=nkT) для идеального газа.
С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (участок кривой АВ на рисунке). Это становится особенно очевидным, если провести изохору через точку A (пунктирная прямая). Происходит это потому, что при нагревании жидкости часть ее превращается в пар, и плотность пара растет. Поэтому, согласно формуле (p=nkT), давление насыщенного пара растет не только в результате повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. Главное различие в поведении идеального газа и насыщенного пара заключается в изменении массы пара при изменении температуры при неизменном объеме (в закрытом сосуде) или при изменении объема при постоянной температуре. С идеальным газом ничего подобного происходить не может (молекулярно-кинетическая теория идеального газа не предусматривает фазового перехода газа в жидкость).
После испарения всей жидкости поведение пара будет соответствовать поведению идеального газа (участок ВС кривой на рисунке выше).
Ненасыщенный пар.
Если в пространстве, содержащем пары какой-либо жидкости, может происходить дальнейшее испарение этой жидкости, то пар, находящийся в этом пространстве, является ненасыщенным.
Пар, не находящийся в состоянии равновесия со своей жидкостью, называется ненасыщенным.
Ненасыщенный пар можно простым сжатием превратить в жидкость. Как только это превращение началось, пар, находящийся в равновесии с жидкостью, становится насыщенным.
Влажность воздуха
Абсолютная влажность
— это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха
— это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1)
следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1)
, напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр
. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее испарится. Что такое испарение и почему оно происходит?





























