Как рассчитать энергию для превращения воды в пар
Превращение воды в пар – это физический процесс, который требует определенного количества энергии. Рассчитать эту энергию можно с использованием формулы для вычисления теплоты испарения.
Формула для вычисления теплоты испарения выглядит следующим образом:
Q = m × Hv
где:
- Q — теплота испарения,
- m — масса вещества (в данном случае вода),
- Hv — удельная теплота испарения.
Удельная теплота испарения для воды составляет около 2260 кДж/кг.
Таким образом, для расчета общей энергии, требующейся для превращения воды в пар, необходимо умножить массу воды на удельную теплоту испарения.
Например, если масса воды равна 1 кг, то общая энергия, требуемая для превращения этой массы в пар, будет равна:
Q = 1 кг × 2260 кДж/кг = 2260 кДж
Таким образом, для превращения 1 килограмма воды в пар требуется 2260 кДж энергии.
Важно учитывать, что энергия, необходимая для превращения воды в пар всегда будет равна произведению массы воды на удельную теплоту испарения, независимо от условий, в которых происходит испарение. Например, при повышенной температуре или давлении, энергия может быть использована для продвижения молекул воды в более высокую энергетическую составляющую (парообразный вид), но энергия для превращения жидкости в газовое состояние все равно остается неизменной
Например, при повышенной температуре или давлении, энергия может быть использована для продвижения молекул воды в более высокую энергетическую составляющую (парообразный вид), но энергия для превращения жидкости в газовое состояние все равно остается неизменной.
Список литературы
- Arons, А. В. and С. F. Kientjler (1954). Vapor Pressure of Seasalt Solutions. Transactions of the American Geophysical Union 35 (5): 722—728.
- Bowditch (1966). Oceanography, Part 6 of American Practical Navigator, H. O. Publication No. 9—Part 6, U. S. Navy Hydrographic Office.
- Brahzt, J. T. (1968). Ocean Engineering. Wiley, New York.
- Handbook of Chemistry and Physics, C. D. Hodgman, Ed. (1958). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Chemistry and Physics, 50th ed., R. C. Weast, Ed. (1969). Chemical Rubber Publishing Company, Cleveland.
- Handbook of Tables for Applied Engineering Science, R. E. Bolz and G. L. Tuve, Eds. (1970). Chemical Rubber Company, Cleveland.
- Hobaica, E. D. (1964). Buoyancy Systems for Deep Submergence Structures. Naval Engineers Journal 75 (5): 733—741.
- International Critical Tables of Numerical Data, Vol. 3 (1928). McGraw—Hill, New York.
- International Critical Tables of Numerical Data, Vol. 4 (1928). McGraw— Hill, New York.
- International Critical Tables of Numerical Data, Vol. 5 (1929). Mc.Graw*-Hill, New York.
- International Oceanographic Tables (1966). National Institute of Oceanography of Great Britain and UNESCO, London.
- King D. A. (1969). Basic Hydrodynamics, Section 2 in Handbook of Ocean-and Underwater Engineering, J. J. Myers, Ed. McGraw—Hill, New York.
- Mechanical Engineers’Handbook. L. S. Marks, Ed. (1941). Me Graw—Hill, New York.
- Mujake, Yasso (1939). Chemical Studies of the Western Pacific Ocean. IV. The Refractive Index of Seawater. Bulletin of the Chemical Society of Japan 14 (6); 239—242.
- Rawson, K. J. and E. C. Tupper (1968). Basic Ship Theory. American Elsevier, New York.
- Reid, George K. (1961). Ecology of Inland Waters and Estuaries. Reinhold,. New York.
- Semioli, W. J. and P. B. Schubert (1974). Conversion Tables for SI Metri-fication. Industrial Press, New York.
- Sverdrup, H. U., Martin W. Johnson, and Richard H. Fleming (1942). The-Oceans—Their Physics, Chemistry and General Biology. Prentice—Hall, Englewood Cliffs, N. J.
- Standard Methods for the Examination of Water and Wastewater, 13 th ed. (1971). American Public Health Association, Washington, D. C.
- Tsurikova, A. P. and V. L. Tsurikov (1971). On the Concept of «Salinity»-Oceanology 11 (2): 282—285.
- Wilson, K. G. and A. B. Arons (1955). Osmotic Pressures of Seawater Solutions Computed from Experimental Vapor Pressure Lowering. Journal of Marine Science 14(2): 195—198.
Удельная теплоемкость воды и пара в природе
Удельная теплоемкость – это величина, определяющая количество теплоты, необходимое для нагревания единицы массы вещества на один градус Цельсия. Вода является уникальным веществом в природе, поскольку ее удельная теплоемкость высока как в жидком состоянии, так и в парообразном.
Удельная теплоемкость воды в жидком состоянии составляет около 4,18 кДж/(кг·°C).
Это означает, что для нагревания одного килограмма воды на один градус Цельсия требуется 4,18 кДж теплоты. Такая высокая теплоемкость играет важную роль в природе.
Благодаря этому свойству воды, большое количество теплоты может быть поглощено или отдано, прежде чем температура воды изменится значительно. Именно поэтому океаны и водные массы служат важным регулятором климата на Земле.
Удельная теплоемкость водяного пара составляет около 2,01 кДж/(кг·°C).
Пар обладает более низкой теплоемкостью, чем жидкость, из-за его меньшей плотности и молекулярной структуры. Однако, пар обладает другими уникальными свойствами, такими как легкость и способность к быстрой конденсации, что делает его важным игроком в природных явлениях.
Водяной пар играет ключевую роль во многих климатических процессах, таких как формирование облаков и выпадение осадков. Парообразование и конденсация воды также являются важными факторами в процессах теплообмена и теплоносители в природных системах.
Выводя общую картину взаимодействия воды и пара с окружающим окружением, можно заключить, что удельная теплоемкость воды и пара играет важную роль в природе, влияя на климатические процессы и обеспечивая теплоносительные свойства в природной среде. Разумное использование и понимание этих свойств является ключом к сохранению и управлению водными ресурсами на планете.
Теплоемкость пара: особенности и методы расчета
Теплоемкость пара – это количественная характеристика, определяющая количество теплоты, необходимой для нагрева единицы массы пара на один градус.
Особенности теплоемкости пара:
- Теплоемкость пара зависит от давления и температуры. С увеличением давления и температуры теплоемкость пара также увеличивается.
- Теплоемкость пара является функцией состава паровой смеси. Если в паровой смеси присутствуют различные компоненты, то теплоемкость пара будет зависеть от их концентрации.
- Теплоемкость пара различается для насыщенного и перегретого пара. Насыщенный пар находится в состоянии равновесия с жидкостью, а перегретый пар имеет температуру выше точки насыщения. Теплоемкость пара будет отличаться в этих состояниях.
Методы расчета теплоемкости пара:
- Метод Дюлонга-Пти – этот метод используется для расчета теплоемкости насыщенного пара в широком диапазоне температур и давлений.
- Метод Шумана-Гуревича – этот метод позволяет расчитывать теплоемкость перегретого пара на основе определенных соотношений.
- Метод Нистена-Интона — данный метод позволяет рассчитывать теплоемкость пара на основе параметров насыщенного пара или его удельной теплоемкости.
Расчет теплоемкости пара играет важную роль в различных областях, таких как электроэнергетика, теплотехника, химическая промышленность и других. Знание теплоемкости пара позволяет оптимизировать процессы нагрева и охлаждения, а также проектировать эффективные теплообменники и котлы.
Упражнения
Упражнение №1
У вас есть вода массой $2 \space кг$ с температурой $20 \degree C$. Рассчитайте, какое количество энергии потребуется для ее превращения в пар.
Дано:$m = 2 \space кг$$t_1 = 20 \degree C$$t_2 = 100 \degree C$$c = 4200 \frac{Дж}{кг \cdot \degree C}$$L = 2.3 \cdot 10^6 \frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала нам потребуется нагреть воду до температуры кипения, затратив на это количество энергии $Q_1$:$Q_1 = cm (t_2 — t_1)$.
$Q_1 = 4200 \frac{Дж}{кг \cdot \degree C} \cdot 2 \space кг \cdot (100 \degree C — 20 \degree C) = 8400 \frac{Дж}{\degree C} \cdot 80 \degree C = 672 \space 000 \space Дж \approx 0.7 \cdot 10^6 \space Дж$.
Теперь рассчитаем количество энергии $Q_2$, затраченное для превращения воды в пар:$Q_2 = Lm$.
$Q_2 = 2.3 \cdot 10^6 \frac{Дж}{кг} \cdot 2 \space кг = 4.6 \cdot 10^6 \space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:$Q = Q_1 + Q_2 = 0.7 \cdot 10^6 \space Дж + 4.6 \cdot 10^6 \space Дж = 5.3 \cdot 10^6 \space Дж$.
Ответ: $Q = 5.3 \cdot 10^6 \space Дж$.
Упражнение №2
Вычислите, какое количество энергии выделится при охлаждении водяного пара массой $2 \space кг$ от $100 \degree C$ до $0 \degree C$.
Дано:$m = 2 \space кг$$t_1 = 100 \degree C$$t_2 = 0 \degree C$$c = 4200 \frac{Дж}{кг \cdot \degree C}$$L = 2.3 \cdot 10^6 \frac{Дж}{кг}$
$Q — ?$
Показать решение
Скрыть
Решение:
Температура $100 \degree C$ — это температура парообразования воды и конденсации водяного пара. При понижении температуры пар сначала сконденсируется в жидкость, а жидкость продолжит охлаждаться.Количество теплоты, выделенное при этом будет равно:$Q = Q_1 + Q_2$, где$Q_1$ — количество выделенной теплоты при конденсации пара,$Q_2$ — количество теплоты, выделенное при охлаждении жидкости до $0 \degree C$.
$Q_1 = Lm$.$Q_1 = 2.3 \cdot 10^6 \frac{Дж}{кг} \cdot 2 \space кг = 4.6 \cdot 10^6 \space Дж$.
$Q_2 = cm (t_1 — t_2)$.$Q_2 = 4200 \frac{Дж}{кг \cdot \degree C} \cdot 2 \space кг \cdot (100 \degree C — 0 \degree C) = 8400 \frac{Дж}{\degree C} \cdot 100 \degree C = 840 \space 000 \space Дж \approx 0.8 \cdot 10^6 \space Дж$.
$Q = 4.6 \cdot 10^6 \space Дж + 0.8 \cdot 10^6 \space Дж= 5.4 \cdot 10^6 \space Дж$.
Ответ: $Q = 5.4 \cdot 10^6 \space Дж$.
Упражнение №3
Из чайника выкипела вода объемом $0.5 \space л$. Начальная температуры этой воды составляла $10 \degree C$. Какое количество энергии оказалось излишне затраченным? Плотность воды — $1000 \frac{кг}{м^3}$.
Дано:$V = 0.5 \space л$$\rho = 1000 \frac{кг}{м^3}$$L = 2.3 \cdot 10^6 \frac{Дж}{кг}$
СИ:$0.5 \cdot 10^{-3} \space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
После закипания воды в чайнике огонь выключают. Если его не выключить, то процесс кипения продолжится, и вода из чайника будет испаряться. Так как превращение воды в пар не является целью кипячения воды, энергию, которая ушла на парообразование можно считать излишне затраченной. Рассчитаем ее по формуле: $Q = Lm$.
Массу мы можем выразить через плотность и объем: $m = \rho V$.
Тогда наша формула примет вид:$Q = L\rho V$.
$Q = 2.3 \cdot 10^6 \frac{Дж}{кг} \cdot 1000\frac{кг}{м^3} \cdot 0.5 \cdot 10^{-3} \space м^3 = 2.3 \cdot 10^6 \frac{Дж}{кг} \cdot 0.5 \space кг = 1.15 \cdot 10^6 \space Дж$.
Ответ: $Q = 1.15 \cdot 10^6 \space Дж$.
2.13: Вода — теплота парообразования
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12670
- Безграничный
- Безграничный
Цели обучения
Объясните, как теплота парообразования связана с температурой кипения воды.
Вода в жидкой форме имеет необычно высокую температуру кипения, значение близкое к 100°C.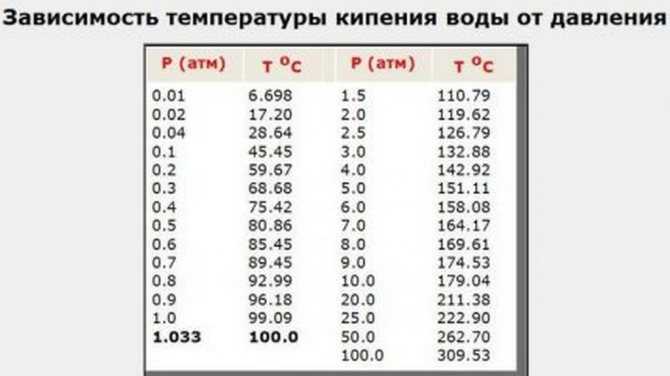
![]()
Рисунок \(\PageIndex{1}\): Влажность, испарение и кипение: (a) Из-за распределения скоростей и кинетической энергии некоторые молекулы воды могут отделяться в паровую фазу даже при температурах ниже обычной точки кипения. (b) Если контейнер запечатан, испарение будет продолжаться до тех пор, пока плотность пара не станет достаточной для того, чтобы скорость конденсации сравнялась со скоростью испарения. Эта плотность пара и создаваемое им парциальное давление являются значениями насыщения. Они увеличиваются с температурой и не зависят от присутствия других газов, таких как воздух. Они зависят только от давления паров воды.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии.![]()
Ключевые моменты
- Диссоциация молекул жидкой воды, превращающая вещество в газ, требует много энергии.
- Температура кипения воды – это температура, при которой имеется достаточно энергии для разрыва водородных связей между молекулами воды.
- Вода превращается из жидкой формы в газообразную (пар), когда достигается теплота парообразования.
- Испарение пота (в основном воды) отводит тепло с поверхности кожи, охлаждая тело.
Ключевые термины
теплота парообразования : Энергия, необходимая для превращения данного количества вещества из жидкости в газ при заданном давлении (часто атмосферном).
Эта страница под названием 2.![]()
- Наверх
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
-
- Теги
-
- теплота парообразования воды
Насыщенный водяной пар
Вернемся к эксперименту. Итак, у нас в закрытой банке
жидкость. Что происходит? Испарение воды. Процесс начинается при низкой
плотности воздуха. Благодаря пару, давление на поверхность жидкости возрастает,
оно препятствует движению молекул. Их все меньше и меньше отрывается от воды.
Наступает момент, когда образуются капли влаги. Этот процесс называется
«конденсация». Когда скорость образования пара равна скорости конденсации,
возникает термодинамическое равновесие. Пар в этот момент считается насыщенным.
Жидкость и газ уравновешивают друг друга. Такое состояние достигается при
определенных условиях, важные параметры:
- Температура, изменение на долю градуса нарушает равновесие. При повышении парообразование ускоряется, при понижении увеличивается процесс конденсации влаги.
- Давление, при его понижении молекулы жидкой фазы свободнее передвигаются, отрываются от поверхности, начинается испарение воды.

Почему не учитывается объем банки? Он не меняет термодинамических свойств воды и водяного пара в состоянии насыщения. Допустим, крышка экспериментальной банки опустилась ниже, объем уменьшился. К чему это приведет? Пар будет ускоренно конденсироваться до момента равновесия. При увеличении объема ускорится парообразование, но замкнутая система опять придет в равновесное состояние.
Изучая термодинамику, легко понять, почему пар обжигает
сильнее воды той же температуры. Что такое кипение? Состояние, при котором
жидкая фаза активно превращается в парообразное состояние. Следовательно,
происходит обратный процесс конденсации, он сопровождается выделением теплоты.
За счет этого ожог от пара сильнее.

Удельная теплоемкость возрастает, если повышается температура
воды. Процесс парообразования виден в момент кипения. При повышении давления
температура газов достигает 200°С, это свойство используется в теплотехнике,
горячим, вязким паром заполняют теплообменники.
Давление насыщенного водяного пара
Формула p=nkT указывает на прямую зависимость давления
идеального газа (p) и его температуры (Т). Параметр n –число молекул,
содержащихся в заданном объеме, характеризует плотность пара. Постоянная
Больцмана k устанавливает взаимосвязь температуры с энергией образования
вещества (энтальпия).
Пар нельзя сравнивать с идеальным газом. Его давление при
повышении температуры растет быстрее из-за повышения плотности. Концентрация
частиц в неизменном объеме возрастает. Эти особенности свойств водяного пара
необходимо учитывать при расчетах давления насыщенного водяного пара. Если в
идеальном газе возрастает энергия ударов молекул о стенки сосуда, то в
насыщенном паре существенно возрастает число ударов за счет увеличения
концентрации активных частиц.

Плотность насыщенного водяного пара
Плотностью называется отношение массы вещества к его объему.
Этот параметр характеризует расстояние между отдельными молекулами. В жидкой
фазе они сцепляются между собой, в твердой расположены симметрично относительно
друг друга. В газообразном находятся на произвольном удаленном расстоянии, чем
объясняется отличие плотности водяного пара от плотности воды.
https://youtube.com/watch?v=QgcI2u-S2y4
Теперь подробно рассмотрим, какое влияние оказывает на
плотность насыщенных водяных паров изменение температуры. Она непостоянна из-за
изменения массы газообразной фазы:
- при повышении температуры она возрастает за счет
ускорения испарения; - при понижении – падает, вода активно
конденсируется.
По сути, она должна постоянно меняться, так как частицы воды
непрерывно движутся, переходят из одного агрегатного состояния в другое. Но при
динамическом равновесии концентрация неизменна: сколько молекул испарится,
столько же конденсируется. Показатели устанавливаются экспериментально для
каждой температуры. Их значения сведены в таблицы.
Испарение и конденсация
Изменение энергии при превращении воды в пар
Превращение воды в пар является фазовым переходом, который требует определенного количества энергии. В данном разделе мы рассмотрим, как изменяется энергия при этом процессе.
Для превращения одного грамма воды в пар требуется определенное количество энергии, которое называется теплотой испарения (Л). Теплота испарения является интенсивной величиной и зависит от температуры.
Обычно теплота испарения воды равна около 2,26 мегаджоулей на килограмм (МДж/кг) при температуре 100 градусов Цельсия и атмосферном давлении. Однако, эту величину можно найти в специальных таблицах для разных температур.
Изменение энергии (Q) при превращении воды в пар можно вычислить, умножив теплоту испарения (Л) на массу воды (m) и на коэффициент изменения температуры (ΔT):
Q = Л * m * ΔT
Где:
- Q — изменение энергии;
- Л — теплота испарения;
- m — масса воды;
- ΔT — изменение температуры.
Величина ΔT представляет собой разницу между начальной и конечной температурами воды. Если вода нагревается до точки кипения и превращается полностью в пар, то ΔT будет равно 100 градусов Цельсия.
Таким образом, при превращении воды в пар, энергия изменяется в соответствии с теплотой испарения и массой воды.
Энергия искрепления воды: возврат в жидкое состояние
Когда вода находится в паровом состоянии, для ее возврата в жидкое состояние требуется освободить определенное количество энергии. Эта энергия называется энергией искрепления воды.
Энергия искрепления воды определяет количество теплоты, которое необходимо извлечь из ее молекул, чтобы они начали сближаться друг с другом и образовывать молекулярные связи.
Энергия искрепления воды составляет около 40.7 кДж/моль при нормальных условиях (температура 0 °C, давление 1 атм). Это означает, что для каждой молекулы воды необходимо освободить 40.7 кДж энергии для того, чтобы она переходила из парового состояния в жидкое состояние при температуре 0 °C.
Энергия искрепления воды важна для понимания множества процессов, связанных с переходами воды между различными агрегатными состояниями. Например, она играет ключевую роль в процессе конденсации, при котором паровая вода превращается в капли дождя или облака.
Изучение энергии искрепления воды также важно для понимания процессов образования и таяния льда. Для перехода из твердого состояния воды в жидкое состояние также требуется освободить энергию искрепления
Энергия искрепления воды зависит от физических условий, в которых происходят переходы состояний. Например, при повышении давления или снижении температуры, энергия искрепления воды увеличивается.
Общая формула для расчета количества энергии, необходимого для искрепления воды, имеет вид:
- Q = m * H
где:
- Q — количество энергии, необходимое для искрепления воды (в Дж)
- m — масса воды (в г)
- H — энергия искрепления воды (в Дж/г)
Таким образом, расчет энергии искрепления воды сводится к умножению массы воды на значение энергии искрепления.
Определение удельной теплоемкости
Удельная теплоемкость – это физическая величина, которая описывает количество теплоты, необходимое для нагрева единицы массы вещества на определенную величину температуры.
Удельная теплоемкость воды и пара является важным параметром, который найдет свое применение в различных областях науки и техники, таких как физика, химия, энергетика и метеорология.
Определение удельной теплоемкости может быть проведено с помощью различных методов. Один из наиболее распространенных методов — метод смешивания.
- В эксперименте необходимо подготовить две термостойкие посуды с измерительными шкалами и крышками.
- В одной из посуд выливается измеренное количество вещества, чья удельная теплоемкость требуется определить.
- В другую посуду выливается измеренное количество вещества, чья удельная теплоемкость известна.
- После этого, две посуды помещаются в водяную или масляную баню, чтобы содержимое достигло одинаковой начальной температуры.
- Затем содержимое из второй посуды переливают в первую посуду и измеряют изменение температуры.
- По формуле удельная теплоемкость вычисляется, используя известные массы и изменение температуры.
Этот метод позволяет определить удельную теплоемкость вещества с хорошей точностью, однако требует большой точности измерений массы и температуры.
Таким образом, определение удельной теплоемкости воды и пара является важной задачей в изучении физических свойств вещества и находит широкое применение в различных областях науки и промышленности
Тепловые свойства воды и пара: температурный диапазон
Удельная теплоемкость воды и пара является важным параметром, который определяет способность вещества поглощать теплоту при нагревании и отдавать ее при охлаждении. Теплоемкость воды и пара зависит от температуры, поэтому у них имеется температурный диапазон, в котором эти свойства проявляются.
Температурный диапазон для воды существенно шире, чем для пара. Вода может находиться в жидком состоянии при температуре от 0°C до 100°C при нормальных атмосферных условиях. При температурах ниже 0°C вода также может находиться в твердом состоянии — льду. Если вода нагревается выше 100°C, она переходит в парообразное состояние.
Тепловые свойства воды значительно меняются в зависимости от ее состояния и температуры. Например, удельная теплоемкость воды в жидком состоянии составляет около 4,18Дж/г·°C, а в паровом состоянии — около 2,0Дж/г·°C.
Температурный диапазон для пара, или водяного пара, составляет значительно более высокие значения. Водяной пар находится в газообразном состоянии при температурах выше 100°C и давлении ниже атмосферного. Водяной пар обладает удельной теплоемкостью, которая также зависит от температуры, но в целом составляет около 2,0Дж/г·°C.
Изучение и понимание тепловых свойств воды и пара позволяет использовать их в различных областях науки и техники. Например, удельная теплоемкость воды и пара используется при расчете тепловых процессов в системах отопления и охлаждения, в процессах парогенерации, в климатической технике и т.д
Также, знание температурного диапазона для воды и пара важно при проведении экспериментов и исследований в различных областях физики и химии
Формула расчета теплоты испарения
Теплота испарения – это количество энергии, которое необходимо передать единице массы вещества, чтобы превратить его из жидкого состояния в газообразное при постоянной температуре и давлении. Формула расчета теплоты испарения выглядит следующим образом:
Q = m * ΔHисп
- Q – теплота испарения вещества (Дж или Дж/кг)
- m – масса испаряющегося вещества (кг)
- ΔHисп – энтальпия испарения (Дж/кг)
Теплоту испарения можно рассчитать, зная массу испаряющегося вещества и его энтальпию испарения. Обычно энтальпия испарения указывается в таблицах свойств вещества или может быть подсчитана с помощью известных термодинамических данных.
Таким образом, формула расчета теплоты испарения позволяет определить необходимую энергию для превращения жидкого вещества в газообразное состояние. Эту формулу можно использовать для решения задач на тему фазовых переходов вещества и расчета энергетических затрат.
Определение и понятие
Удельная теплота испарения воды — это количество теплоты, которое необходимо передать единичной массе воды при ее испарении при определенной температуре и давлении.
Удельная теплота испарения воды является важным физическим свойством и зависит от давления и температуры окружающей среды. Обычно она измеряется при нормальном атмосферном давлении и равна около 2 257 кДж/кг или 540 ккал/кг.
Удельная теплота испарения воды объясняет, почему при испарении воды температура окружающей среды может снижаться, поскольку энергия уходит на превращение воды в пар. Это также объясняет, почему испарение является охлаждающим процессом.
Удельная теплота испарения воды также играет важную роль в природных процессах, таких как погода и климат. Она влияет на образование облачности, выпадение осадков и циркуляцию воздуха в атмосфере.

























