Температура кипения
Перегретый пар отличается от насыщенного пара температурой кипения. Если жидкость нагревается до температуры, превышающей ее температуру кипения при данном давлении, то она переходит в состояние перегретого пара. В этом случае между жидкостью и ее паром нет равновесия, и пар может иметь температуру выше температуры кипения.
Насыщенный пар образуется в тот момент, когда температура жидкости достигает ее температуры кипения при данном давлении. В этом состоянии жидкость и ее пар находятся в равновесии, и пар имеет точно такую же температуру, что и жидкость. Если дальнейше нагревать насыщенный пар без изменения давления, он переходит в состояние перегретого пара.
Важно отметить, что перегретый пар имеет большую энергию, чем насыщенный пар. Перегретый пар может быть опасным, так как может привести к образованию парового взрыва при быстром снижении давления или при взаимодействии с веществами, чувствительными к высокой температуре
Сверхкритическая вода
Сверхкритическая вода — это вода в состоянии, превышающем ее критическую точку: 22,1 МПа, 374 °C. В критической точке скрытое тепло пара равняется нулю, а его удельный объем точно такой же, как для жидкого или газообразного состояния. Другими словами, вода с давлением и температурой большими, чем в критической точке, находится в своеобразном состоянии, которое нельзя назвать ни жидким, ни газообразным.
Сверхкритическая вода используется для работы турбин на электростанциях, которые требуют более высокой эффективности. Исследования сверхкритической воды проводятся с упором на ее использование в качестве текущей среды, обладающей свойствами как жидкости, так и газа, а также на ее пригодность в качестве растворителя для химических реакций.
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Влажный пар и его свойства
Влажный пар отличается от сухого и насыщенного пара тем, что содержит определенное количество водяного пара в смеси с воздухом. В отличие от ненасыщенного пара, влажный пар находится в термодинамическом равновесии с водой.
При достижении насыщения влажного пара, его свойства изменяются. Влажный пар становится насыщенным, что означает, что его содержание водяного пара в воздухе достигает предельного значения при определенной температуре и давлении.
Влажный пар имеет свои уникальные свойства. Он более тяжелый и имеет большую плотность, чем сухой пар. Влажный пар также обладает более высокой теплоемкостью и теплопроводностью. Это свойство позволяет использовать влажный пар для передачи тепла и выполнять различные процессы, связанные с теплом.
Влажный пар важен в различных отраслях промышленности и технологии. Он используется в паровых турбинах для производства электроэнергии, в паропроизводящих котлах для отопления и горячего водоснабжения, а также в процессах кондиционирования воздуха и влажности в помещении.
Изучение свойств и характеристик влажного пара играет важную роль в проектировании и эксплуатации систем, связанных с паровыми процессами. Понимание особенностей его поведения позволяет эффективно использовать его в различных процессах и повышает эффективность работы энергетических установок.
Образование водяного пара. Конденсация водяного пара:
Водяной пар может быть получен в результате испарения или кипения жидкой воды, а также в результате сублимации льда. При испарении пар образуется только на поверхности вещества, при кипении же пар образуется по всему объему жидкости.
В обычных атмосферных условиях водяной пар непрерывно образуется в результате испарения и конденсируется в жидкое состояние.
Кипение воды происходит при температурах, которые зависят от химического состава водного раствора и атмосферного давления.
При нормальном давлении окружающей среды 1 атм. (101,325 кПа) вода кипит при 100 °C. Температура кипения остается неизменной на протяжении всего процесса. Так, если в оставшуюся воду подается энергия (тепло), она испаряется без дальнейшего повышения температуры. Из 1 литра (соответственно 1 кг) воды образуется 1673 литра водяного пара (в нормальных условиях), для чего требуются затраты энергии 2257 кДж.
При поступлении водяного пара в воздух он, как и все другие газы, создаёт определённое давление, называемое парциальным. Парциальное давление (лат. partialis – «частичный» от pars – «часть») – давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Обратные образованию водяного пара процессы именуются конденсацией и десублимацией. Водяной пар будет конденсироваться на другую поверхность только тогда, когда эта поверхность будет более холодной, чем температура точки росы, или когда равновесие водяного пара в воздухе будет превышено.
В атмосфере конденсация водяного пара приводит к образованию облаков, тумана и осадков, а десублимация – снега.
Конденсация и кипение
Процессы конденсации и кипения являются взаимно обратными процессами, отражая фазовый переход вещества из газообразного состояния в жидкость и наоборот.
Основными теоретико-методологическими вопросами, которые решаются в рамках данной области, являются возможности прогнозировать их протекание в прикладных целях.
Основными прикладными направлениями, для которых важны знания о процессах конденсации и кипения, являются решение исследовательских и практических задач в сфере естествознания, применение в метрологии, проектирование производственных комплексов и оборудования в химической, металлургической промышленности, а также других отраслях национальной экономической системы.
Молекулярно-кинетическая теория опирается на определенные представления о строении вещества и оперирует моделями вещества, с помощью которых устанавливаются законы поведения макроскопических систем, состоящих из бесконечно большого числа отдельных частиц. «Молекулярно-кинетическая теория – это учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ» . Следует отметить, что молекулярно-кинетическая теория описывает поведение различных систем на основе вероятностных моделей, чтобы установить взаимозависимость между макроскопическими величинами и микроскопическими характеристиками частиц. К макроскопическим величинам относятся, например, температура, объем, давление и др., а к микроскопическим характеристикам частиц – энергия, масса, импульс и др.
Таким образом, термодинамический и статистический подходы взаимно дополняют друг друга, поскольку только комплексное использование в научных изысканиях термодинамики и молекулярно-кинетической теории позволяет сформировать наиболее полное представление о свойствах систем, состоящих из бесконечно большого числа отдельных частиц.
В зависимости от условий и их изменения любой вещество может находиться в трех разных агрегатных состояниях: твердое, жидкое, газообразное. Процесс перехода из одного состояния в другое является фазовым переходом. Реальные газы, например, азот, водород, кислород и др., могут превратиться в жидкость при соблюдении определенных условий. Превращение газа в жидкость может наблюдаться только при температурах, которые ниже критической температуры (Ткр). «Например, для воды критическая температура – 647,3 К, азота – 126 К, кислорода – 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов» .
Фазовый переход из жидкого состояния в газообразное называется испарением. При этом процессе с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т.е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Фазовый переход, при котором молекулы пара возвращаются в жидкое состояние, называется конденсацией и является обратным процессу испарения.
«Процесс кипения жидкости происходит при температуре, при которой давление ее насыщенных паров становится равным внешнему давлению» . Поскольку в жидкости всегда имеются мельчайшие пузырьки газа, испарение может происходить в объеме жидкости в случае, если давление насыщенного пара жидкости равно давлению газа в пузырьках или больше него. Вследствие этого жидкость будет испаряться внутрь пузырьков, что приведет к расширению пузырьков газа, которые будут всплывать на поверхность.
Свойства насыщенного пара
Насыщенный пар обладает определенными свойствами. Среди них отмечаются:
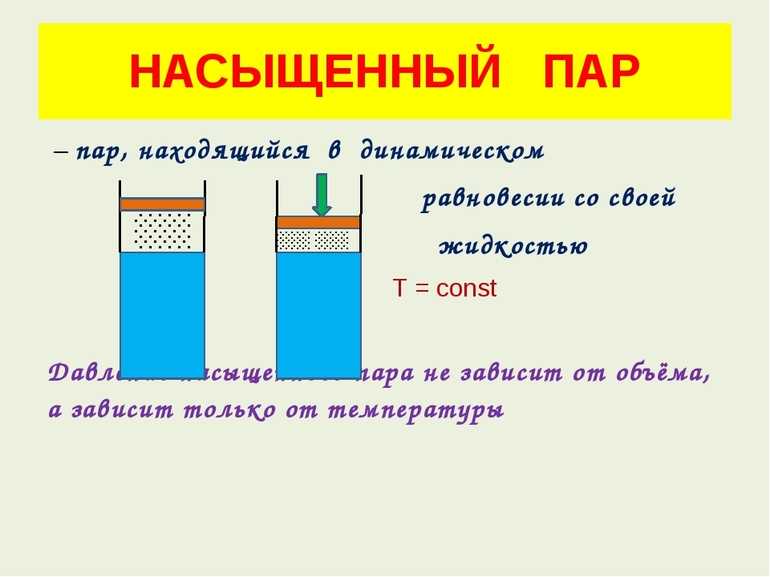
- Его плотность при постоянной температуре не зависит от объема. Если уменьшить объем сосуда, с присутствующим там газообразным веществом, то молекулы начнут переходить в водную среду. Так будет происходить до того времени, пока не наступит динамическое равновесие. Этот процесс не зависит от объема, а плотность газообразной среды останется прежней.
- Величина давления не связана с объемом. При уменьшении давления некоторое количество молекул перейдут в газообразную среду и равновесие восстановится.
- С повышением или понижением температуры при одинаковом объеме соответственно изменяется плотность. С увеличением градусов начинается процесс испарения, а с уменьшением происходит конденсация. Наблюдается это до тех пор, пока в обоих случаях не наступит динамическое равновесие.
- При повышении температуры давление возрастает быстрее, чем по линейному закону.
Сухой пар и его свойства
Сухой пар отличается от перегретого, влажного и ненасыщенного пара своими особыми свойствами. В отличие от влажного пара, сухой пар не содержит водяных капель и имеет самую низкую влажность. Он образуется при нагреве воды до определенной температуры и давления, когда водные молекулы переходят в парообразное состояние, не образуя капель.
Ненасыщенный пар является смесью пара и жидкости. Его свойства и характеристики сильно зависят от концентрации воды в паре. В отличие от ненасыщенного пара, сухой пар является чистым паром, не содержащим жидкости.
Одно из основных свойств сухого пара — его высокая температура. Перегретый пар имеет температуру выше точки кипения воды при данном давлении. В отличие от перегретого пара, сухой пар образуется при точке кипения воды и имеет температуру, соответствующую этой точке.
Сухой пар также характеризуется своей плотностью и газообразным состоянием. Он не обладает свойствами жидкости и насыщенного пара, и легко проникает в промежутки между молекулами воздуха.
Насыщенный пар — что это такое, определение
Если говорится, что в опытах используется водяной насыщенный пар, то это значит, что он находится в термодинамическом равновесии с плоской поверхностью жидкости либо льда.
Чтобы понять механизм перехода молекул жидкости в воздух, вспомним о трех агрегатных состояниях веществ. Среди них:
- твердое;
- жидкое;
- газообразное.
Разницу между ними обуславливает строение молекулярной решетки веществ, т.е. расположение молекул относительно друг друга. При обычных внешних условиях агрегатное состояние вещества — свойство стабильное. Однако когда внешние условия меняются, в т.ч. когда внутренняя энергия вырастает, возможны различные фазовые переходы. Причиной этому могут послужить, например, нагревание, охлаждение.
Он может происходить двумя вариантами:
- кипением;
- испарением.
В первом случае это происходит при поглощении энергии, т.е. телу необходимо подвести теплоту. Это ведет к увеличению внутренней энергии, способности молекул разорвать межмолекулярные связи и покинуть поверхность жидкости.
При испарении молекулы жидкости переходят в газ со свободной поверхности. К примеру, недавно заваренный чай некоторое время «парит», поскольку вода недавно кипела. Испарение происходит и у жидкости обычной температуры, поскольку разница ее температуры с воздухом все-таки существует. Такое испарение менее интенсивно, однако оно не равно нулю. Кроме того, в физике существует явление диффузии и молекулы покидают поверхность жидкости, переходя в воздух, вследствие нее.
Чем отличается от ненасыщенного
В отличие от насыщенного пара, для ненасыщенного характерно:
- Меньшие значения таких параметров, как плотность и давление. Чем менее пар насыщен, тем они меньше. Данное правило работает при условии, что температура не меняется.
- Справедливость закона Бойля-Мариотта (при постоянных температуре и массе объем увеличивается/уменьшается так же интенсивно, как давление). Давление обратно пропорционально объему. Насыщенный пар, имеющий максимальную плотность и давление (Т постоянна), не обнаруживает зависимости между давлением и объемом.
- При сохраняемом объеме плотность не зависит от температуры, поэтому объем будет постоянным при неизменности плотности. Для насыщенного пара характерно, что плотность меняется при изменении температуры.
- При постоянном объеме справедлив закон Шарля: увеличение температуры ведет к такому же увеличению давления. Зависимость носит линейный характер. Насыщенный пар характеризуется тем, что давление растет интенсивнее при увеличении температуры — зависимость экспоненциальная.
Физические свойства
Перегретый пар и насыщенный пар обладают различными физическими свойствами, которые определяют их состояние и поведение.
| Перегретый пар | Насыщенный пар | |
|---|---|---|
| Температура | Выше температуры насыщения | Температура насыщения |
| Давление | Выше насыщенного давления | Насыщенное давление |
| Энергия | Выше энергии насыщения | Энергия насыщения |
| Плотность | Ниже плотности насыщенного пара | Плотность насыщенного пара |
| Удельный объем | Больше удельного объема насыщенного пара | Удельный объем насыщенного пара |
Перегретый пар образуется при нагревании насыщенного пара при фиксированном давлении. Это означает, что перегретый пар содержит больше энергии и имеет высокую температуру и давление, чем насыщенный пар.
В отличие от перегретого пара, насыщенный пар находится в равновесии с жидким состоянием и имеет конкретные значения температуры и давления. Насыщенный пар обычно используется для передачи энергии или работы в технических процессах, таких как электростанции или паровые двигатели.
Физика процесса
Переход вещества из жидкого состояния в парообразное в физике называется парообразованием.
Обратный процесс перехода из газообразного состояния в твёрдое или жидкое, называется конденсация. Например, скопление облаков или наступающий туман.
Выделяют два вида парообразования:
- испарение;
- кипение.
В первом случае необходимо достичь порога температуры плавления, преодолев его. А при кипении у каждого жидкого вещества своя определенная температура, до достижении которой образуется пар.
Область парообразования в этих случаях тоже отличается.
- При испарении пар образуется со свободной поверхности, которая граничит с окружающими ее газами – кислородом и др.
- При кипении образование пара происходит со всего объема жидкости.
Образование пара при кипении
Для наглядности посмотрим, как же образуется пар при кипении на рисунке № 1.
Пузырьки пара образуются во всем объеме жидкости, поднимаются на её поверхность и лопаются, высвобождая горячий пар в в воздух.
Когда вода кипятится, ей передается некоторое количество теплоты, благодаря чему у молекул воды увеличивается внутренняя энергия. Это приводит к тому, что эти молекулы беспорядочно движутся и сталкиваются друг с другом, за счет чего вода закипает.
Пар выделяется в растворенных газах, которые есть в воде. Именно пар как раз и находится в тех пузырьках, которые образуются при кипячении.
Пузырек лопается, чтобы высвободить постоянно увеличивающийся пар. Все это происходит под привыкший для всех нас звук бурления. Но многие пузырьки лопаются внутри воды, не успевая достичь свободной поверхности.
Формула
Физические процессы основаны на формулах. Не является исключением и парообразование.
Если величина будет показывать, сколько теплоты (дж) нужно для обращения жидкости (кг) в пар при испарении при указанной температуре в отсутствие ее изменения, тогда она будет называться удельной теплотой парообразования и конденсации. Обозначается она как L и при расчете используется формула:
Удельная теплота парообразования при различных температурах будет отличаться. Например, при достижении температуры кипения это значение будет самым низким.
Эта величина имеет особое значение во многих сферах производства, например при производстве металлов.
Выяснилось, что когда плавится железо, после его повторного затвердевания возникшая кристаллическая решетка оказывается намного прочнее предыдущей.
Определить удельную теплоту возможно только путем эксперимента, а ее основные значения уже давно установлены. Например, для спирта это 0,9*106, а для воды 2,3*106.
Изменяется удельная теплота парообразования воды и в зависимости от давления. Здесь наблюдается как раз обратная зависимость – когда давление воды увеличивается, снижается значение удельной теплоты парообразования.
При атмосферном давлении в 760 мм рт. ст. удельная теплота парообразования равна 2258 кДж/кг.
Характерным примером может явиться покорение альпинистами высоких гор.
На особых высотах (более 3000 м) из-за пониженного атмосферного давления, уменьшается и температура кипения воды (до 90°С), что усложняет процесс приготовления еды, поскольку требуется больше времени, чтобы произвести термическую обработку пищи.
А на более высоких местностях (около 7000 м.) готовить еду становится практически невозможно из-за падения температуры кипения до 50 °С.
При рассмотрении температуры воды необходимо упомянуть еще одну физическую величину – удельную теплоемкость. Она равняется количеству теплоты, необходимому для передачи единичной массе вещества, чтобы изменить его температуру на единицу.
Если теплота не сопровождается изменением температуры при изменении своего состояния, такая теплота называется скрытой. Скрытая теплота может наблюдаться как раз при парообразовании.
Она также отличается при разных жидкостях и изменяется в зависимости от давления.
При увеличении атмосферного давления и как следствие увеличении температуры жидкости, уменьшается скрытая теплота парообразования.
Чем отличается пар от газа?
Агрегатное состояние вещества задается температурой, точнее соотношением между энергией, с которой взаимодействуют его молекулы и энергией их теплового хаотического движения. Приближенно, можно считать, что если энергия взаимодействия значительно больше – твердое состояние, если значительно больше энергия теплового движения — газообразное, если энергии сравнимы – жидкое.
Молекула газа
Получается, чтобы молекула могла оторваться от жидкости и участвовать в образовании пара, величина тепловой энергии должна быть больше энергии взаимодействия. Как это может произойти? Средняя скорость теплового движения молекул равна определенному значению, зависящему от температуры. Однако индивидуальные скорости молекул различны: большая их часть обладает скоростями близкими к среднему значению, но некоторая часть имеет скорости больше средней, некоторая — меньше.
Более быстрые молекулы могут иметь тепловую энергию большую, чем энергия взаимодействия, а значит, попав на поверхность жидкости, способны оторваться от нее, образуя пар. Такой способ парообразования называется испарением. Из-за того же распределения скоростей существует и противоположный процесс — конденсация: молекулы из пара переходят в жидкость. Кстати образы, которые обычно возникают при слове пар, это не пар, а результат противоположного процесса — конденсации. Пар увидеть нельзя.

Испарение
Пар при определенных условиях может стать жидкостью, но для этого его температура не должна превышать определенного значения. Это значение называется критической температурой. Пар и газ — газообразные состояния, отличающиеся температурой, при которой они существуют. Если температура не превышает критической — пар, если превышает – газ. Если поддерживать температуру постоянной и уменьшать объем, пар — сжижается, газ – не сжижается.
Водяной пар в воздухе, плотность водяного пара:
Водяной пар – газообразное агрегатное состояние воды .
Водяной пар не имеет цвета, вкуса и запаха.
Водяной пар, как и вода, – это бинарное неорганическое соединение с химической формулой H2O.
Молекула водяного пара, как и молекула воды, состоит из двух атомов водорода и одного – кислорода, которые соединены между собой ковалентной связью.
Водяной пар содержится в воздухе – в атмосфере Земли (в основном в тропосфере). Концентрация водяного пара в воздухе (в атмосфере Земли) составляет в среднем 0,25 % по массе от массы всей атмосферы Земли. Концентрация водяного пара в воздухе (в атмосфере Земли) по объему (в пересчете на сухой воздух) значительно варьируется от примерно 0,0001 % по объему в самых холодных частях атмосферы до 5% по объему в горячих, влажных воздушных массах.
Водяной пар легче и менее плотный, чем сухой воздух. Так, плотность сухого воздуха при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C составляет 1,292 кг/м 3 (или 0,001292 г/см 3 ), при температуре 20 °C – 1,2041 кг/м 3 (или 0,0012041 г/см 3 ). Плотность водяного пара при нормальном атмосферном давлении (101 325 Па или 1 атм.) и температуре 0 °C составляет 0,803 кг/м 3 (или 0,000803 г/см 3 ), при температуре 20 °C – 0,749 кг/м 3 (или 0,000749 г/см 3 ).
Плотность водяного пара (m/V) находится с использованием уравнения Клайперона – Менделеева (уравнения состояния идеального газа):
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура газа, К,
Свойства насыщенного пара
Насыщенный пар обладает определенными свойствами. Среди них отмечаются:
- Его плотность при постоянной температуре не зависит от объема. Если уменьшить объем сосуда, с присутствующим там газообразным веществом, то молекулы начнут переходить в водную среду. Так будет происходить до того времени, пока не наступит динамическое равновесие. Этот процесс не зависит от объема, а плотность газообразной среды останется прежней.
- Величина давления не связана с объемом. При уменьшении давления некоторое количество молекул перейдут в газообразную среду и равновесие восстановится.
- С повышением или понижением температуры при одинаковом объеме соответственно изменяется плотность. С увеличением градусов начинается процесс испарения, а с уменьшением происходит конденсация. Наблюдается это до тех пор, пока в обоих случаях не наступит динамическое равновесие.
- При повышении температуры давление возрастает быстрее, чем по линейному закону.
Основные отличия насыщенного пара от ненасыщенного
- Насыщенный означает, что данный объект имеет самое большое из возможных значений некоторых параметров. Для пара — это плотность и давление. Эти параметры для ненасыщенного пара имеют меньшие значения. Чем дальше пар от насыщения, тем меньше эти величины. Одно уточнение: температура сравнения должна быть постоянной.
- Для ненасыщенного пара выполняется закон Бойля-Мариотта: если температура и масса газа постоянны, увеличение или уменьшение объема, вызывает уменьшение или увеличение давления во столько же раз, давление и объем — связаны обратно пропорциональной зависимостью. Из максимальности плотности и давления при постоянной температуре вытекает их независимость от объема насыщенного пара, получается, что для насыщенного пара давление и объем — не зависят друг от друга.
- Для ненасыщенного пара плотность не зависит от температуры, и если объем сохраняется, не меняется и значение плотности. Для насыщенного пара при сохранении объема плотность изменяется, если изменяется температура. Зависимость в данном случае прямая. Если увеличивается температура, увеличивается и плотность, если температура уменьшается, так же изменяется плотность.
- Если объем постоянен, ненасыщенный пар ведет себя в соответствии с законом Шарля: при увеличении температуры во столько же раз увеличивается и давление. Такая зависимость называется линейной. У насыщенного пара при увеличении температуры давление возрастает быстрее, чем у ненасыщенного пара. Зависимость имеет экспоненциальный характер.
Подводя итог, можно отметить значительные различия свойств сравниваемых объектов. Основное отличие в том, что пар, в состоянии насыщения, нельзя рассматривать в отрыве от его жидкости. Это двухкомпонентная система, к которой нельзя применять большинство газовых законов.














![§ 33. испарение жидкостей. пары [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](http://meridian-complex.ru/wp-content/uploads/5/4/2/542d87d9c97807bbf1e50eb74c59ac52.jpeg)











![Сухой пар [влажный, свежий] что это такое, свойства и виды](http://meridian-complex.ru/wp-content/uploads/e/4/f/e4f007d14a3c3c87adccb842780fbf54.jpeg)
