Формула для величины

Формула выглядит так: L = Q/m, где
- Q – теплота,
- m – масса.
Ее часто используют для расчетов энергетических затрат на выпаривание воды из растворов: Q= L* m.
L определяют в лабораториях и заносят в таблицы, составляют справочники, которыми можно пользоваться любому желающему. При этом всегда указывают температуру и давление, при которых находилось L.
С ростом температуры L уменьшается, так как жидкость расширяется, взаимодействие между ее частицами уменьшается, и ее легче превратить в пар. Когда плотность пара и жидкости сравниваются, наступает критическое состояние.
Оно характеризуется определенным давлением и температурой. Для воды — это 374 ℃ и 218,5 атм. В таком состоянии L=0.
Алгоритм и правила расчета

Для решения большинства задач используют следующий алгоритм:
- Анализируют, как проходит процесс, какое вещество отдает, а какое получает тепло.
- Переводят все единицы измерения в одну систему.
- Записывают необходимые формулы.
- Решают уравнение с одним неизвестным.
При проведении расчетов надо следить за размерностью величин. В системе СИ масса измеряется в кг, теплота в Дж, а температура в градусах Кельвина. Разность температур можно считать в градусах Цельсия.
Часто бывает нужно найти удельную теплоту парообразования при условиях кипения жидкости и нормальном атмосферном давлении (760 мм рт. ст.). В таких условиях получают чистую воду из растворов или выделяют из смеси веществ ее части.
Процесс используется в химической и пищевой промышленности и даже на бытовом уровне.
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫПАРООБРАЗОВАНИЯ ВОДЫ
Цель работы: Определить удельную теплоту парообразования
Теория
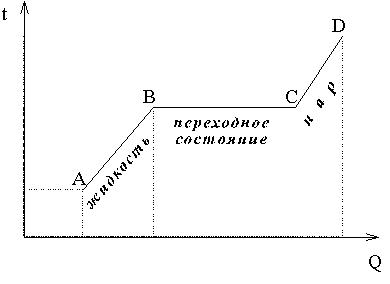
Если нагревать некоторое количество воды и при этом измерять ее температуру и количество теплоты Q, подводимое к ней, то зависимость t от Q выразится графиком, изображенным на рис. 1.
Рис. 1
Из графика видно, что вначале, по мере нагревания, температура жидкости растет пропорционально количеству подводимой теплоты Q (участок AB на графике).
Повышение температуры жидкости при нагревании указывает на увеличение средней кинетической энергии молекул.
Но, начиная с некоторого момента, рост температуры прекращается, хотя теплота по-прежнему подводится к жидкости (участок BC). Это – переходное состояние, здесь происходит переход из жидкого состояния в парообразное. Увеличение потока теплоты может лишь ускорить ход парообразования, но не изменяет температуры парообразования. Теплота в этом случае затрачивается на изменение связей между молекулами жидкости.
Различаются жидкости по количеству теплоты, которое требуется для превращения единицы массы каждой из них в пар при одинаковых условиях. Поэтому для характеристики этого свойства жидкостей вводится особая величина, называемая удельной теплотой парообразования.
Удельная теплота парообразования есть величина, измеряемая количеством теплоты, необходимым для превращения 1 кг жидкости в пар при температуре парообразования.
Если обозначить удельную теплоту парообразования через r, массу испарившейся жидкости через m, количество теплоты, необходимое для парообразования, через Q, то Q = r * m.
При конденсации каждый килограмм пара выделяет количество теплоты, которое потребовалось бы при той же температуре для преобразования 1 кг жидкости в пар.
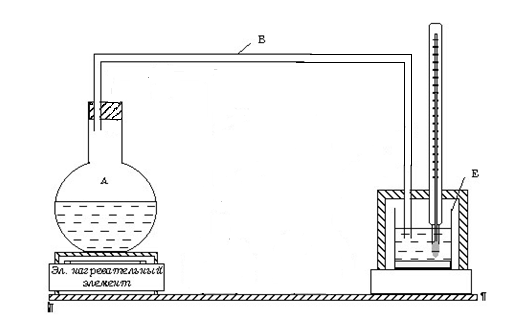
Рис. 2
Прибор для определения удельной теплоты парообразования воды состоит из парообразователя A с исследуемой жидкостью, проводящей трубки B и калориметра E (рис. 2). В данной работе удельная теплота парообразования воды определяется на основании уравнения теплового баланса. Количество теплоты, отданное всеми остывшими телами, равно количеству теплоты, полученному всеми нагревающимися телами.
Применим этот закон для нашего случая. Пусть в калориметр массой m1, удельная теплоемкость которого равна C1, налито m2 граммов воды при температуре t1. В воду пропущено m3 граммов водяного пара при температуре кипения tk = 100° C.
Пусть θ – окончательная температура смеси. Пар, попадая в калориметр, прежде всего, сконденсируется в воду без изменения температуры. При этом он отдаст количество теплоты:
|
(1) |
Вода, полученная из пара при остывании от температуры кипения tk=100° C до температуры смеси, отдаст количество теплоты:
|
(2) |
где C2 – удельная теплоемкость воды.
Заказать работы
Калориметр с водой, в свою очередь, нагревается. Теплота, полученная калориметром:
|
(3) |
Теплота, полученная водой в калориметре:
|
(4) |
На основании уравнения теплового баланса:
или
|
|
(5) |
Отсюда, удельная теплота парообразования воды равняется:
|
|
(6) |
|
Таблица 1 |
|||||
|
m1,г |
m2,г |
m3,г |
t1, ° C |
θ, ° C |
r |
барометру
|
Температура кипения воды при различных давлениях |
|||||
|
Таблица 2 P, мм рт. ст. |
t, ° C |
P, мм рт. ст. |
t, ° C |
P, мм рт. ст. |
t, ° C |
|
680 |
96,91 |
725 |
98,68 |
770 |
100,37 |
|
685 |
97,12 |
730 |
98,88 |
775 |
100,35 |
|
690 |
97,32 |
735 |
99,07 |
780 |
100,73 |
|
695 |
97,51 |
740 |
99,25 |
785 |
100,91 |
|
700 |
97,71 |
745 |
99,44 |
790 |
101,09 |
|
705 |
97,91 |
750 |
99,63 |
795 |
101,27 |
|
710 |
98,10 |
755 |
99,82 |
799 |
101,41 |
|
715 |
98,30 |
760 |
100,00 |
||
|
720 |
98,49 |
765 |
100,18 |
Физическое явление — кипение
Второй способ парообразования — это кипение, характеризующееся, в отличие от испарения, тем, что образование пара происходит не только на поверхности, но и по всей массе жидкости. Кипение становится возможным, если давление насыщенных паров жидкости делается равным внешнему давлению. Поэтому данная жидкость, находясь под данным внешним давлением, кипит при вполне определенной температуре. Обычно температуру кипения приводят для атмосферного давления. Например, вода при атмосферном давлении кипит при 373 К или 100°С.
Различие температур кипения различных веществ находит применение в технике для так называемой разгонки смесей, компоненты, которых сильно отличаются по температуре кипения, например, для перегонки нефтепродуктов.
Зависимость температуры кипения от давления объясняется тем, что внешнее давление препятствует росту пузырьков пара внутри жидкости, Поэтому при повышенном давлении жидкость кипит при более высокой температуре. При изменении давления точка кипения меняется в более широких пределах, чем точка плавления.
Кипение — это особый вид парообразования, отличный от испарения. Внешние признаки кипения: на стенках сосуда появляются большое количество мелких пузырьков; объем пузырьков увеличивается и начинает сказываться подъемная сила; внутри жидкости происходят более или менее бурные и неправильные движения пузырьков. На поверхности пузырьки лопаются Процесс всплывания, разрушения пузырьков, заполненных воздухом с паром, на поверхности жидкости характеризует кипение. Жидкости имеют свои температуры кипения.
Пузырьки, образующиеся при кипении жидкости, легче всего возникают на пузырьках воздуха или других газов, обычно присутствующих в жидкости. Такие пузырьки — центры кипения — часто прилипают к стенкам сосуда, потому кипение раньше начинается у стенок.
В пузырьках воздуха содержатся водяные пары. Благодаря многочисленным пузырькам резко возрастает поверхность испарения жидкости. Образование пара идет по всему объему сосуда. Отсюда и характерные признаки кипения: бурление, резкое увеличение количества пара, прекращение роста температуры до полного выкипания.
Но если жидкость свободно от газов, то образование в ней пузырьков пара затруднено. Такую жидкость можно перегреть, то есть нагреть выше температуры кипения без того, чтобы она закипела. Если в такую перегретую жидкость ввести ничтожное количество газа или твердых частичек, к поверхности которых прилип воздух, то она мгновенно взрывообразно закипит. Температура жидкости при этом падает до температуры кипения. Подобные явления могут служить причиной взрывов паровых котлов, поэтому их нужно предупреждать. Еще в 1924 году Ф. Кендрику с сотрудниками удалось при нормальном атмосферном давлении нагреть жидкую воду до 270ºC. При этой температуре равновесное давление водяного пара составляет 54 атм. Из сказанного следует, процессы кипения можно управлять, увеличение или уменьшение давления, а также уменьшая число «затравок». Современные исследования показали, что в идеальном случае воду нагреть примерно до 300ºC, после чего она мгновенно мутнеет и взрывается с образованием быстро расширяющейся паро-водяной смеси.
Таким образом, кипение, как и испарение, — это парообразование. Испарение происходит с поверхности жидкости при любой температуре и любом внешнем давлении, а кипение — это парообразование во всем объеме жидкости при определенной для каждого вещества температуре, зависящей от внешнего давления.
Чтобы температура испаряющейся жидкости не изменялась, к жидкости необходимо подводить определенные количества теплоты. Физическая величина, показывающая количество теплоты необходимо, чтобы обратить жидкость с массой 1 кг в пар без изменения температуры называют удельной теплотой парообразования. Обозначается эта величина буквой L, измеряется Дж/кг. = Дж/кг
Конденсация пара — противоположный процесс парообразования Явление парообразования и конденсации объясняют круговорот воды в природе, образование тумана, выпадения росы.
Количество теплоты, которое выделяет пар, конденсируясь, определяется по той же формуле. = Дж
Опытным путем установлено, что, например, удельная теплота парообразования воды при 100°С равна 2,3 106Дж/кг, то есть для превращения воды с массой 1 кг в пар при температуре кипения 100°С требуется 2,3 106Дж энергии.
Удельная теплота конденсации
Нужно ли сообщать пару энергию при его конденсации? Давайте рассмотрим простой опыт (рисунок 1).
Нальем в сосуд воду и закроем его пробкой. Через пробку проведем трубку и направим ее на кусочек охлажденного стекла. Доведем воду до кипения с помощью горелки.
Рисунок 1. Выделение энергии при конденсации пара
Пар, поднимающийся над кипящей водой, будет конденсироваться, соприкасаясь с холодным стеклом. Если мы дотронемся до стекла, то обнаружим, что оно очень сильно нагрелось.
Так энергия пара передается стеклу. В результате этой потери энергии пар конденсируется. Если бы температура стекла была равна температуре пара, то теплопередача бы не происходила, и конденсат не образовывался бы.
Это говорит о том, что при конденсации пар отдает, выделяет энергию.
Более точные опыты также показывают, что
Значит, при превращении $1 space кг$ водяного пара в воду при температуре $100 degree C$ выделяется $2.3 cdot 10^6 space Дж$ энергии.
Это довольно большая энергия, поэтому человечество стремится ее использовать. Например, на крупных тепловых электростанциях паром, который уже прошел через турбины, нагревают воду. Ее, в свою очередь, используют для отопления зданий и бытовых нужд.
Почему твердое становится жидким?
Нагревание твердого тела приводит к увеличению кинетической энергии атомов и молекул, которые при нормальной температуре находятся четко в узлах кристаллической решетки, что и позволяет телу сохранять постоянные форму и размеры. При достижении некоторых критических значений скоростей атомы и молекулы начинают покидать свои места, происходит разрыв связей, тело начинает терять свою форму — становится жидким. Процесс плавление происходит не резким скачком, а постепенно, так, что некоторое время твердая и жидкая компоненты (фазы) находятся в равновесии. Плавление относится к эндотермическим процессам, то есть к таким которые происходят с поглощением теплоты. Противоположный процесс, когда жидкость затвердевает называется кристаллизацией.
Рис. 1. Переход твердого, кристаллического, состояния вещества в жидкую фазу.
Было обнаружено, что до окончания процесса плавления температура не изменяется, хотя тепло все время поступает. Никакого противоречия здесь нет, так как поступающая энергия в этот период времени уходит на разрыв кристаллических связей решетки. После разрушения всех связей приток тепла будет повышать кинетическую энергию молекул, а следовательно, температура начнет расти.
Рис. 2. График зависимости температуры тела от времени нагрева.
Что такое пароообразование?
Парообразованием называют изменение капельными жидкостями агрегатного состояния, в результате чего они из жидкости превращаются в пар.
Если этот процесс происходит на поверхности воды, то он называется испарением. Когда он затрагивает весь объём, то происходит кипение, для чего нужно поддерживать конкретную температуру и давление насыщенного пара.
Кипение
Кипение — это процесс, происходящий внутри объёма жидкости. При комнатной t вода крайне насыщена воздухом, но в ней присутствуют пузырьки, свидетельствующие о наличии газа.
При нагревании он будет выделяться на стенки и дно сосуда. Это приводит к формированию воздушных пузырьков, а, находящаяся в них жидкость, начнёт испаряться, если давление пара станет больше давления газа, находящегося в пузырьках.
В процессе нагревания, наполненные паром пузырьки расширяются, что приводит к их всплыванию на поверхность. При кипении в жидкости всё время формируются пузырьки пара, через которые она испаряется. Для этого нужна определённая температура и давление.
При достижении температуры кипения молекулы начинают наращивать и поглощать тепловую энергию и энергию движения тела. Это приводит к увеличению скорости испарения, которое будет происходить, пока воздушные массы остаются насыщенными.
Если давление внешней среды приравняется к внутреннему молекулярному давлению жидкости, начнет происходить кипение, сопровождающееся преобразованием воды в пар.
Кипение бывает двух видов:
- Пузырьковое. Пузырьковое кипение заключается во время от времени появляющихся и увеличивающихся пузырьках. Если этот процесс происходит медленно, то они наполняются паром. Их увеличение в размерах происходит за счёт быстрого испарения жидкости, что провоцирует их всплытие и образование пара.
- Плёночное. Плёночное кипение возникает, когда некоторые пузырьки сливаются вместе до определённой критической отметки. Это приводит к формированию сплошного слоя пара, который время от времени прорывается в тело жидкости.
Испарение
Испарение — процесс спонтанный, происходящий при температуре 20 — 25°C и спровоцированный перемещением высокоэнергетических молекул, переходящих в воздушную массу.
Находясь в жидкости, молекулы обладают некоторой степенью свободы и определённым количеством энергии движения тела, побуждающей их переходить в газовую фазу, справляясь со сдерживающим их напряжением. Переходят из жидкой в газообразную фазу молекулы, находящиеся на поверхности, так как им для этого нужно мало энергии.
Однако это доступно и молекулам, располагающимся глубже в структуре жидкости, при условии, что у них есть достаточная для этого энергия движения тела, позволяющая преодолеть сопротивление поверхности и не сталкиваться с другими молекулами, находящимися внутри.
Испарение будет происходить, пока, находящийся над жидкой средой, воздух будет оставаться ненасыщенным.
Только в этом случае воздух примет молекулы паров, поглощающие тепловую энергию. В результате процесса испарения происходит снижение температуры той части жидкости, которая не преобразуется в пар.
Испарение становится возможным благодаря следующим особенностям молекулярной структуры жидкости:
- молекулы расположены очень близко одна к другой;
- отсутствует привязка молекул к каким-либо центрам, что позволяет им свободно перемещаться по всему телу жидкости;
- существуют силы притяжения, связывающие молекулы между собой;
- молекулы всё время находятся недалеко от собственного положения равновесия.
Чтобы произошло испарение, необходимо выполнить одно важное условие: накопление молекулами энергии движении тела, которая будет выше их связи другими молекулами в структуре жидкости. Это позволит им вылетать с поверхности и образовывать над ней пар. Однако для молекул характерно хаотичное движение, в результате которого они возвращаются в жидкое состояние, а часть из них теряется безвозвратно
Оставшиеся в структуре тела жидкости молекулы характеризуются сокращением средних показателей энергия движения тела, что приведёт к снижению температуры
Однако для молекул характерно хаотичное движение, в результате которого они возвращаются в жидкое состояние, а часть из них теряется безвозвратно. Оставшиеся в структуре тела жидкости молекулы характеризуются сокращением средних показателей энергия движения тела, что приведёт к снижению температуры.
Несколько примеров нахождения
Задача №1. Сколько необходимо энергии для превращения в пар следующих кипящих веществ:
- 2 кг этилового спирта;
- 2 кг воды;
- 2 кг расплавленного свинца.
Необходимо воспользоваться формулой Q= L* m и взять значение L из таблицы. Получится:
- 0,84*МДж*2 кг = 1,68 МДж;
- 2,3 МДж*2 кг = 4,6 МДж;
- 8,6 МДж *2 кг = 17,2 МДж.
Как видно, превратить в пар воду сложнее, чем этанол, но легче, чем металл. На первый взгляд, это очевидно, но когда дело касается веществ, близких по температуре кипения, то разница становится менее заметна, ее невозможно угадать. Тем не менее, она имеет особое значение.
Задача №2. Как вычислить, сколько энергии необходимо, чтобы превратить 1 тонну воды при 20 ℃ в пар при 100 ℃?
Решение: 1 т = 1000 кг.

Q = Q1 +Q2, где
- Q1 – тепло, ушедшее на нагревание воды с 20 до 100 градусов,
- Q2 – тепло, необходимое для образования пара (процесс происходит без изменения температуры).
Q1 = С*M* (T2-T1), С воды = 4200 Дж/(кг*К), Q2 = L*M, L воды при обычном кипении = 2,3 МДж/кг, T2-T1 = 100-20 = 80.
Подставляя известные величины, находят искомую энергию: Q = 4200*1000*80+2,3 *106*1000 = 4,2*80*106+2300*106=2636 (МДж)
Задача №3. Сколько надо затратить электроэнергии, чтобы превратить 1 л воды в пар?
Решение: Q= Lводы*m. Масса 1 литра обычной водопроводной воды равна 1 кг. Q=2260 кДж/кг *1 кг=2260 кДж=2,3 МДж.
1 кВт*ч = 3,6 МДж. Из простой пропорции следует, что надо затратить 0,64 кВт*ч. Для 2-х литров величина возрастет в 2 раза, для 3-х – в три, и так далее.
Зная тарифы на электроэнергию, несложно посчитать стоимость, во сколько рублей обойдется такое кипячение. Надо также учитывать, что частично энергия уйдет в воздух и на нагрев сосуда, частей плиты, поэтому реальный расход будет выше.
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Определение удельной теплоты плавления
Удельной теплотой плавления (обозначение — греческая буква “лямбда” – λ ), называется физическая величина равная количеству тепла (в джоулях), которое необходимо передать твердому телу массой 1 кг, чтобы полностью перевести его в жидкую фазу. Формула удельной теплоты плавления выглядит так:
$$ λ ={Q over m}$$
где:
m — масса плавящегося вещества;
Q — количество тепла, переданное веществу при плавлении.
Значения для разных веществ определяют экспериментально.
Зная λ, можно вычислить количество тепла, которое необходимо сообщить телу массой m для его полного расплавления:
$$Q={λ*m}$$
Расчёт[править | править код]
Удельная теплота парообразования и конденсации обозначается буквой . Рассчитывается по формуле
где Q — теплота, истраченная на превращение жидкости в пар или пара в жидкость, m — масса.
Наименьшее значение удельной теплоты парообразования будет при температуре кипения жидкости.
Размерность удельной теплоты парообразования в СИ — Дж/кг. Устаревшие, но иногда применяемые единицы для теплоты парообразования — ккал/кг и кал/кг.
В химии теплота парообразования обычно приводится к молю вещества. Эта величина называется молярной теплотой испарения (конденсации); единица её измерения — Дж/моль. Также используются устаревшие единицы: ккал/моль, кал/моль.
Какие данные нужны, чтобы рассчитать значение?
Чтобы вычислить искомую величину, применяют знания о том, что теплота испарения равна теплоте конденсации со знаком «минус». Это значит, что когда пар конденсируется (превращается в воду), он охлаждается и отдает свое тепло окружающей среде. Можно применить формулу: Q= L* m.
Для расчетов необходимы следующие данные:
- Q – теплота, отданная паром, Дж,
- m – масса образовавшейся в процессе конденсации воды, кг;
- L – удельная теплота парообразования, Дж/кг – собственно то, что нужно определить.
Применяют также закон сохранения энергии и понятие теплоемкости: Qв=С*Mв*(T2-T1), где:
- С – удельная теплоемкость воды, которая нагревается под действием сконденсированного пара, Дж/(кг*К), – считается известной и берется из таблицы,
- Mв – ее масса;
- T2-T1 – изменение температуры в Кельвинах или градусах Цельсия.
Что это за параметр, в чем измеряется?
Удельная теплота парообразования — это часть энергии, затрачиваемая на переход определенной массы воды из жидкого в газообразное состояние.
Эта энергия является тепловой и возникает в результате температуры, до которой жидкость нагревается источником тепла. Этот параметр также относится к конденсации водяного пара в жидком состоянии.
Единицей измерения удельного тепла является джоуль на килограмм массы (Дж/кг). Этот параметр обозначается латинской буквой «L».
Удельная теплоемкость воды определяется по температуре кипения 100 градусов и составляет 2,26*106 Дж/кг или 2,26 мДж. Он также приводится в килокалориях на килограмм массы (ккал/кг) и соответствует 4,1 Дж.
Значение удельной теплоты парообразования равно значению конденсации при тех же температуре и массовых параметрах воды. Это связано с тем, что часть тепла выделяется при обратном переходе от пара к жидкости.
Таблица удельной теплоты плавления
Значение удельной теплоты для разных веществ: золота, серебра, цинка, олова и многих других металлов можно найти в специальных таблицах и справочниках. Обычно эти значения приводятся в виде таблицы.
Вашему вниманию таблица удельной теплоты плавления разных веществ
| Вещество | 105 * Дж/кг | ккал/кг | Вещество | 105 * Дж/кг | ккал/кг |
| Алюминий | 3,8 | 92 | Ртуть | 0,1 | 3,0 |
| Железо | 2,7 | 65 | Свинец | 0,3 | 6,0 |
| Лед | 3,3 | 80 | Серебро | 0,87 | 21 |
| Медь | 1,8 | 42 | Сталь | 0,8 | 20 |
| Нафталин | 1,5 | 36 | Цинк | 1,2 | 28 |
| Олово | 0,58 | 14 | Платина | 1,01 | 24,1 |
| Парафин | 1,5 | 35 | Золото | 0,66 | 15,8 |
Интересный факт: самым тугоплавким металлом на сегодняшний день является карбид тантала – ТаС. Для его плавления необходима температура 3990 С. Покрытия из ТаС применяют для защиты металлических форм, в которых отливают детали из алюминия
Упражнения
Упражнение №1
У вас есть вода массой $2 space кг$ с температурой $20 degree C$. Рассчитайте, какое количество энергии потребуется для ее превращения в пар.
Дано:$m = 2 space кг$$t_1 = 20 degree C$$t_2 = 100 degree C$$c = 4200 frac{Дж}{кг cdot degree C}$$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение и ответ
Скрыть
Решение:
Сначала нам потребуется нагреть воду до температуры кипения, затратив на это количество энергии $Q_1$:$Q_1 = cm (t_2 — t_1)$.
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 20 degree C) = 8400 frac{Дж}{degree C} cdot 80 degree C = 672 space 000 space Дж approx 0.7 cdot 10^6 space Дж$.
Теперь рассчитаем количество энергии $Q_2$, затраченное для превращения воды в пар:$Q_2 = Lm$.
$Q_2 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
Рассчитаем общее количество энергии, которое нам потребуется:$Q = Q_1 + Q_2 = 0.7 cdot 10^6 space Дж + 4.6 cdot 10^6 space Дж = 5.3 cdot 10^6 space Дж$.
Ответ: $Q = 5.3 cdot 10^6 space Дж$.
Упражнение №2
Вычислите, какое количество энергии выделится при охлаждении водяного пара массой $2 space кг$ от $100 degree C$ до $0 degree C$.
Дано:$m = 2 space кг$$t_1 = 100 degree C$$t_2 = 0 degree C$$c = 4200 frac{Дж}{кг cdot degree C}$$L = 2.3 cdot 10^6 frac{Дж}{кг}$
$Q — ?$
Показать решение
Скрыть
Решение:
Температура $100 degree C$ — это температура парообразования воды и конденсации водяного пара. При понижении температуры пар сначала сконденсируется в жидкость, а жидкость продолжит охлаждаться.Количество теплоты, выделенное при этом будет равно:$Q = Q_1 + Q_2$, где$Q_1$ — количество выделенной теплоты при конденсации пара,$Q_2$ — количество теплоты, выделенное при охлаждении жидкости до $0 degree C$.
$Q_1 = Lm$.$Q_1 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 2 space кг = 4.6 cdot 10^6 space Дж$.
$Q_2 = cm (t_1 — t_2)$.$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 2 space кг cdot (100 degree C — 0 degree C) = 8400 frac{Дж}{degree C} cdot 100 degree C = 840 space 000 space Дж approx 0.8 cdot 10^6 space Дж$.
$Q = 4.6 cdot 10^6 space Дж + 0.8 cdot 10^6 space Дж= 5.4 cdot 10^6 space Дж$.
Ответ: $Q = 5.4 cdot 10^6 space Дж$.
Упражнение №3
Из чайника выкипела вода объемом $0.5 space л$. Начальная температуры этой воды составляла $10 degree C$. Какое количество энергии оказалось излишне затраченным? Плотность воды — $1000 frac{кг}{м^3}$.
Дано:$V = 0.5 space л$$rho = 1000 frac{кг}{м^3}$$L = 2.3 cdot 10^6 frac{Дж}{кг}$
СИ:$0.5 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
После закипания воды в чайнике огонь выключают. Если его не выключить, то процесс кипения продолжится, и вода из чайника будет испаряться. Так как превращение воды в пар не является целью кипячения воды, энергию, которая ушла на парообразование можно считать излишне затраченной. Рассчитаем ее по формуле: $Q = Lm$.
Массу мы можем выразить через плотность и объем: $m = rho V$.
Тогда наша формула примет вид:$Q = Lrho V$.
$Q = 2.3 cdot 10^6 frac{Дж}{кг} cdot 1000frac{кг}{м^3} cdot 0.5 cdot 10^{-3} space м^3 = 2.3 cdot 10^6 frac{Дж}{кг} cdot 0.5 space кг = 1.15 cdot 10^6 space Дж$.
Ответ: $Q = 1.15 cdot 10^6 space Дж$.


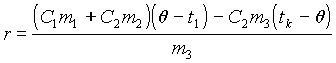















![§ 33. испарение жидкостей. пары [1975 ковалев п.г., хлиян м.д. - физика (молекулярная физика, электродинамика)]](http://meridian-complex.ru/wp-content/uploads/0/6/6/066c20efe5c0bc2fcad9c701b8fb9d74.jpeg)










